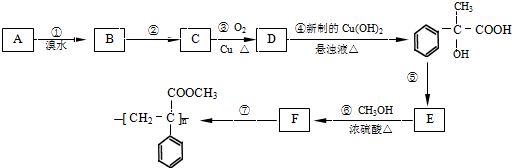
题目内容
 工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:| 压强/Mpa NH3含量/% 温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
A.增大压强 B.减小压强
C.提高温度 D.降低温度
(2)根据表中数据,画出在30MPa下,NH3的百分含量随温度的变化曲线图. 在实际生产中,控制温度在
500℃左右,其原因是
(3)若生产1mol NH3时放出46.2kJ热量,写出合成氨的热化学方程式
(4)在500℃、30MPa条件下反应达到平衡时H2的转化率为
考点:化学平衡的影响因素,热化学方程式,化学平衡的计算
专题:化学平衡专题
分析:(1)看表的横行可知,在温度相同时,随着压强的增大,平衡混合物中氨的体积分数逐渐增大,压强增大平衡正向移动,说明正反应是一个分子数减小的反应,表格的纵行可知,在压强相同时,随着温度的升高,平衡混合物中氨的体积分数逐渐减小,平衡逆向移动,说明合成氨的反应是放热反应,据此答题;
(2)根据表格中的数据作图;但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度;
(3)若生产1mol NH3时放出46.2kJ热量,生成2mol氨气放热92.4KJ,反应为放热反应,反应的焓变为-92.4KJ/mol,依据热化学方程式书写得到;
(4)根据三行式分析相关数据,综合解题.
(2)根据表格中的数据作图;但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度;
(3)若生产1mol NH3时放出46.2kJ热量,生成2mol氨气放热92.4KJ,反应为放热反应,反应的焓变为-92.4KJ/mol,依据热化学方程式书写得到;
(4)根据三行式分析相关数据,综合解题.
解答:
解:(1)看表的横行可知,在温度相同时,随着压强的增大,平衡混合物中氨的体积分数逐渐增大,压强增大平衡正向移动,说明正反应是一个分子数减小的反应,表格的纵行可知,在压强相同时,随着温度的升高,平衡混合物中氨的体积分数逐渐减小,平衡逆向移动,说明合成氨的反应是放热反应,故选:AD;
(2)根据表格中的数据作图,用描点法: ,使用催化剂也能增大反应速率,但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度,故答案为:
,使用催化剂也能增大反应速率,但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度,故答案为: ;该温度时,催化剂的活性最大,有利于增大反应速率,提高产量;
;该温度时,催化剂的活性最大,有利于增大反应速率,提高产量;
(3)生成2mol氨气放热92.4KJ,反应为放热反应,反应的焓变为-92.4KJ/mol,反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g),△H=-92.4KJ/mol;
故答案为:N2(g)+3H2(g)=2NH3(g),△H=-92.4KJ/mol;
(4)N2(g)+3H2(g)=2NH3(g),
初起:1mol 3mol 0
变化:amol 3amol 2amol
平衡:(1-a)mol (3-3a)mol 2amol
此时氨的百分含量为:
=26.4,解之得a=0.42,所以达到平衡时H2的转化率为
×100%=42%;
N2(g)+3H2(g)=2NH3(g),
初起:1mol 3mol 0
变化:xmol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
由平衡混合物中NH3的百分含量为a%,则
=a%,解之得x=
,所以原混合气体与平衡混合气体的总物质的量之比为4:(4-
)=
,
故答案为:42%;
.
(2)根据表格中的数据作图,用描点法:
 ,使用催化剂也能增大反应速率,但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度,故答案为:
,使用催化剂也能增大反应速率,但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度,故答案为: ;该温度时,催化剂的活性最大,有利于增大反应速率,提高产量;
;该温度时,催化剂的活性最大,有利于增大反应速率,提高产量;(3)生成2mol氨气放热92.4KJ,反应为放热反应,反应的焓变为-92.4KJ/mol,反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g),△H=-92.4KJ/mol;
故答案为:N2(g)+3H2(g)=2NH3(g),△H=-92.4KJ/mol;
(4)N2(g)+3H2(g)=2NH3(g),
初起:1mol 3mol 0
变化:amol 3amol 2amol
平衡:(1-a)mol (3-3a)mol 2amol
此时氨的百分含量为:
| 2a |
| 4-2a |
| 0.42×3 |
| 3 |
N2(g)+3H2(g)=2NH3(g),
初起:1mol 3mol 0
变化:xmol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
由平衡混合物中NH3的百分含量为a%,则
| 2x |
| 4-2x |
| 2a |
| 100+a |
| 4a |
| 100+a |
| 100+a |
| 100 |
故答案为:42%;
| 100+a |
| 100 |
点评:本题考查了化学平衡的移动原理、影响化学反应速率的因素、热化学方程式的书写方法和转化率的相关问题,掌握基础是解题关键,题目较简单.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
2.4gCu投入适量的浓硝酸充分反应后,铜粉完全溶解,收集到1.2L标准状态下的气体,如将此气体通过足量水,最后收集到标准状况下气体的体积为( )
| A、560mL |
| B、448mL |
| C、600mL |
| D、400mL |
将2gNaOH固体溶于水配成250mL溶液,溶液中NaOH的物质的量浓度为( )
| A、0.04mol/L |
| B、0.2mol/L |
| C、1mol/L |
| D、2m01/L |
下列化学用语表达正确的是( )
| A、碳酸氢钠的电离方程式:NaHCO3═Na++H++CO32- |
| B、碳酸钙的沉淀溶解平衡表达式:CaCO3(s)?Ca2+(aq)+CO32-(aq) |
| C、氯化铝发生水解的离子方程式:Al3++3H2O═Al(OH)3+3H+ |
| D、亚硫酸的电离方程式:H2SO3?2H++SO32- |
下列物质的化学用语正确的是( )
①NH4H的电子式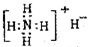
②硝基苯的结构简式:
③葡萄糖的实验式:CH2O
④甲烷分子的比例模型:
⑤Fe2+的离子结构:
⑥原子核内有10个中子的氧原子:
O.
①NH4H的电子式
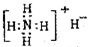
②硝基苯的结构简式:

③葡萄糖的实验式:CH2O
④甲烷分子的比例模型:

⑤Fe2+的离子结构:

⑥原子核内有10个中子的氧原子:
18 8 |
| A、②③⑥ | B、①③⑤⑥ |
| C、③⑥ | D、①②③④⑤⑥ |