题目内容
在同温同压下,有一瓶混有空气的氨气(空气占
)、一瓶纯氨气、一瓶纯二氧化氮气体,将它们分别做喷泉实验,设瓶内液体不外溢,则所得三种溶液的物质的量浓度比为 .
| 1 |
| 5 |
考点:物质的量浓度的相关计算
专题:
分析:根据相同条件下,气体体积之比等于物质的量之比,再依据氨气、氯化氢溶于水形成溶液,溶液体积等于气体体积,二氧化氮溶于水,发生反应形成硝酸溶液,判断烧瓶中溶液的体积、溶质的物质的量,再根据物质的量浓度公式判断浓度比.
解答:
解:相同条件下,气体体积之比等于物质的量之比,混有空气的氨气(空气占
)中的氨气、纯氨气、纯二氧化氮气体的物质的量之比为0.8:1:1,设烧瓶的体积为V,该条件下气体摩尔体积为Vm,因为氨气溶于水形成溶液,溶液体积等于气体体积,所以混有空气的氨气(空气占
)的物质的量是
,物资的量浓度是:
=
;纯氨气的物质的量浓度相等均为:c=
=
=
;
二氧化氮溶于水,发生反应3NO2+H2O=2HNO3+NO,则
3NO2+H2O=2HNO3+NO
3 2 1
所以V体积二氧化氮完全反应生成硝酸的物质的量为:
=
;所以所得三种溶液的物质的量浓度比为1:1:1,故答案为:1:1:1.
| 1 |
| 5 |
| 1 |
| 5 |
| 4V |
| 5×22.4 |
| ||
|
| 1 |
| Vm |
| n |
| V |
| ||
| V |
| 1 |
| Vm |
二氧化氮溶于水,发生反应3NO2+H2O=2HNO3+NO,则
3NO2+H2O=2HNO3+NO
3 2 1
所以V体积二氧化氮完全反应生成硝酸的物质的量为:
| ||
|
| 1 |
| Vm |
点评:本题考查物质的量计算,题目难度中等,关键明白溶液体积与气体体积的关系.

练习册系列答案
相关题目
 一定温度下,某容积恒定的密闭容器中发生如下可逆反应:
一定温度下,某容积恒定的密闭容器中发生如下可逆反应:CO(g)+H2(g)?C(s)+H2O(g);△H<0以l mol CO和2mol H2为起始反应物,tl时达到平衡,生成0.6mol H2O(g).t2时改变反应条件,化学反应速率(v)与时间(t)的关系如图所示.下列叙述正确的是( )
| A、起始时刻和t1达到平衡后气体的物质的量之比为5:4 |
| B、平衡后若加入少量碳,平衡向逆反应方向移动 |
| C、平衡后若加入氢气,上述反应的△H会增大 |
| D、t2时改变的条件可能是升高温度 |
 ,(注:R,R′为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.
,(注:R,R′为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.
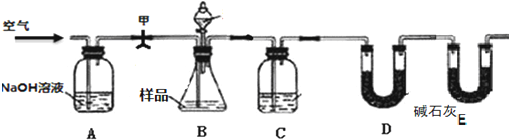
 有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答:
有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答:
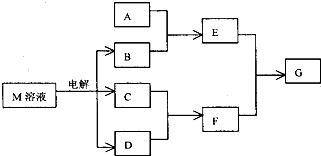 已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):
已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):