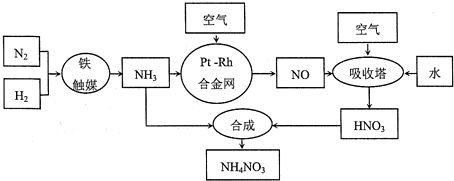
题目内容
2.下列化学用语的表示正确的是( )| A. | 过氧化钠电子式: | |
| B. | 质子数35、中子数45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子结构示意图: | |
| D. | HClO的结构式:H-Cl-O |
分析 A.过氧化钠为离子化合物,电子式中需要标出所带电荷;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.硫离子的核外电子总数为18,最外层达到8电子稳定结构;
D.次氯酸的中心原子为O原子,分子中不存在H-Cl键.
解答 解:A.过氧化钠是离子化合物,由钠离子与过氧根离子构成,其正确的电子式为 ,故A错误;
,故A错误;
B.质子数35、中子数45的溴原子的质量数为80,该核素的表示方法为:${\;}_{35}^{80}$Br,故B正确;
C. 为硫原子结构示意图,硫离子核外存在18个电子核内有16个质子,其正确的离子结构示意图为:
为硫原子结构示意图,硫离子核外存在18个电子核内有16个质子,其正确的离子结构示意图为: ,故C错误;
,故C错误;
D.HClO分子中含有1个H-O键和1个O-H键,其正确的结构式为:H-O-Cl,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及结构式、离子结构示意图、电子式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
12.600K时,庚烷发生反应C7H16(g)$\stackrel{△}{→}$CmHn(g)+CpHq(g)+CxHy(g)(已配平),测得反应前后容器内压强分别是1.01×105Pa和2.02×105Pa(均在600K测定),则庚烷的分解率为( )
| A. | 20% | B. | 50% | C. | 66.7% | D. | 80% |
13.下列药品可用带玻璃塞的试剂瓶储存的是( )
| A. | 稀HCl | B. | HF酸 | C. | NaOH溶液 | D. | Na2SiO3溶液 |
10.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 1735Cl与1737Cl得电子能力相同 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
17.在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量成为键能(kJ•mol-1).下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
(1)根据上表中的数据判断工业合成氨的反应是放热(填“吸热”或“放热”)反应;
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应. 理论上放出或吸收的热量为Q1,则Q1为93KJ.
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是B
A.Q1>Q2B.Q1<Q2 C.Q1=Q2.
| 共价键 | H2分子 | N2分子 | NH3分子 |
| 键能(KJ•mo1-1) | 436 | 945 | 391 |
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应. 理论上放出或吸收的热量为Q1,则Q1为93KJ.
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是B
A.Q1>Q2B.Q1<Q2 C.Q1=Q2.
11.2015年8月12日晚天津港危化品发生爆炸,造成重大财产损失和人员伤亡.据报道事发仓库里存放了大量的硝酸铵、氰化钠(NaCN)、电石(CaC2)和金属钠等危险化学品.下列有关叙述不正确的是( )

| A. | 硝酸铵、氰化钠、电石和金属钠均属于电解质 | |
| B. | CN-中C元素显+2价,N元素显-3价,则非金属性N>C | |
| C. | 氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡 | |
| D. | 电石属于危化品中的遇湿易燃固体,需贴上右图标志,其着火时不能用水灭火 |
12.已知:常温下,H2CO3 Ka1=4.2×10-7,Ka2=5.6×10-11,某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者所占的物质的量分数(a)随溶液pH变化关系如图所示,下列叙述错误的是( )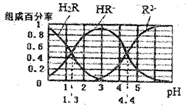

| A. | 在pH=4.4的溶液中:3c(HR-)=c(Na+)+c(H+)-c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水小 | |
| C. | 在pH=3的溶液中存在 $\frac{c({R}^{2-})×c({H}_{2}R)}{c(H{R}^{-})^{2}}$=10-3.1 | |
| D. | 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR- |