题目内容
14.硝酸铵可用作化肥、军用炸药、杀虫剂、冷冻剂等,工业制取硝酸铵的工艺流程如下: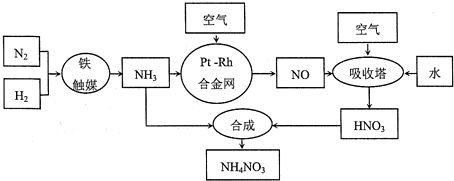
(1)合成氨气的工业设备名称是合成塔,设备中设置热交换器的目的是充分利用热能,合成氨的原料气必须先脱硫,目的是防止催化剂中毒;
(2)吸收塔中反应的化学方程式为2NO+O2=2NO2、3NO2+H2O=2HNO3+NO(或4NO2+O2+2H2O=4HNO3),从生产流程看,吸收塔中需要补充空气,其原因是可使NO循环利用,提高原料利用率;
(3)生产硝酸的过程中常会产生氮的氧化物,可用如下三种方法处理:
方法一:碱性溶液吸收法
NO+NO2+2NaOH═2NaNO2+H2O;2NO2+Na2CO3═NaNO2+NaNO3+CO2
方法二:NH3还原法
8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H=-2635kJ/mol(NO也有类似的反应)
方法三:甲烷吸收法
CH4(g)+2NO2═CO2(g)+N2+2H2O(g)△H=+867kJ/mol(NO也有类似的反应)
上述三种方法中,方法一的主要缺点是单独的NO不能被吸收;
方法三和方法二相比,方法三的缺点是耗能高;
(4)工业上也可以通过电解NO制备NH4NO3,其工作原理如图所示.
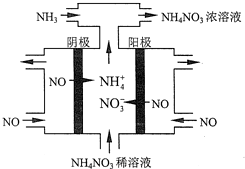
①图中通入NH3的目的是为了使电解产物全部转化为NH4NO3;
②若维持电流强度为3A,电解2小时,理论上可制得NH4NO3的最大质量为6.0g;(已知F=96500C•mol-l)(保留2位有效数字).
(5)某化肥厂用NH3制备NH4NO3.己知:NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其他损耗)的百分比为54.4%.
分析 (1)合成氨的工业设备是合成塔;合成氨的反应属于放热反应;合成氨的原料气必须先脱硫,生产中应防止催化剂中毒;
(2)在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸;
(3)方法一最大的缺点是单独的NO不能被吸收,只能与NO2一起被碱液吸收;方法三和方法二相比,优点是甲烷比氨价格便宜;缺点是方法三的耗能较高;
(4)①工业上电解NO制备 NH4NO3,由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,结合电极方程式解答;
②根据转移的电子守恒解答;
(5)根据氮原子守恒可知,NH3~NO~HNO3,以此计算.
解答 解:(1)合成氨的工业设备是合成塔;合成氨的反应属于放热反应,反应过程中会放出大量的热,用热交换器可以充分利用余热,节约能源;N2与H2合成NH3,生产中原料气必须进行脱硫可以防止催化剂中毒;
故答案为:合成塔;充分利用热能,节约能源;防止催化剂中毒;
(2)在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮2NO+O2=2NO2,二氧化氮再与水反应生成硝酸3NO2+H2O=2HNO3+NO,这样使NO循环利用,全部转化为硝酸,反应的化学方程式为4NO+3O2+2H2O=4HNO3;
故答案为:2NO+O2=2NO2、3NO2+H2O=2HNO3+NO(或4NO2+O2+2H2O=4HNO3);可使NO循环利用,提高原料利用率;
(3)方法一最大的缺点是单独的NO不能被吸收,只能与NO2一起被碱液吸收;方法三和方法二相比,优点是甲烷比氨价格便宜,节约成本;缺点是方法三的反应热为+867kJ•mol-1,耗能较高;
故答案为:单独的NO不能被吸收;耗能高;
(4)①电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此补充NH3,使电解产物全部转化为NH4NO3,
故答案为:使电解产物全部转化为NH4NO3;
②维持电流强度为3A,电解2小时,时间为7200S,F=96500C•mol-1,Q=It=3.0C/s×7200S,则理论上可制得NH4NO3的最大质量为$\frac{3.0C/S×7200S}{\frac{96500C/mol}{3}}$×80g/mol=6.0g,
故答案为:6.0;
(5)由NH3制NO的产率是94%、NO制HNO3的产率是89%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×94%×89%=0.8366mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8366mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为 $\frac{1mol}{1mol+0.8366mol}$×100%=54.4%;即制HNO3所用去的NH3的质量占总耗NH3质量的54.4%,
故答案为:54.4%.
点评 本题考查了工业制备原理应用,流程分析,实验制备物质的分析判断,利用物质的转化及质量守恒的方法来进行计算,明确转化中的化学反应得出物质之间的关系是解答的关键,题目难度中等.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案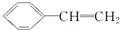 )有下列叙述:
)有下列叙述:①能使酸性KMnO4溶液褪色;
②能使溴的四氯化碳溶液褪色;
③可溶于水;
④可溶于苯中;
⑤能与浓硝酸发生取代反应;
⑥所有的原子一定共平面.
其中正确的是( )
| A. | ①②③④⑤ | B. | ①②⑤⑥ | C. | ①②④⑤⑥ | D. | ①②④⑤ |
| A. |  向容量瓶中转移液体 | B. |  蒸干NH4Cl饱和溶液制备NH4Cl晶体 | ||
| C. |  中和热的测定 | D. |  分离四氯化碳和水 |
| A. | 过氧化钠电子式: | |
| B. | 质子数35、中子数45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子结构示意图: | |
| D. | HClO的结构式:H-Cl-O |
| A. | 农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 | |
| B. | 工业废水可经过“再生”处理,用于城市道路保洁、喷泉和浇花用水 | |
| C. | 硅单质常作为制备光导纤维的主要材料 | |
| D. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 |
| A. | CH3Cl只存在一种空间结构 | |
| B. | CH2Cl2只存在一种空间结构 | |
| C. | CHCl3只存在一种空间结构 | |
| D. | CH4的四个价键的键角和键长都相等 |

 .
.