题目内容
17.在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量成为键能(kJ•mol-1).下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)| 共价键 | H2分子 | N2分子 | NH3分子 |
| 键能(KJ•mo1-1) | 436 | 945 | 391 |
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应. 理论上放出或吸收的热量为Q1,则Q1为93KJ.
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是B
A.Q1>Q2B.Q1<Q2 C.Q1=Q2.
分析 (1)根据反应物、生成物键能的相对大小判断该反应是发热反应还是吸热反应;
(2)根据化学反应的反应热知识,反应物与生成物的键能差即为热量Q1;
(3)合成氨是可逆反应,反应物不能完全转化为生成物.
解答 解:(1)形成化学键放出能量,破坏化学键吸收能量;N2+3H2 2NH3,Q=反应物的键能-生成物的键能=945KJ+3×436-2×3×391KJ=-93KJ<0,所以该反应是放热反应,
2NH3,Q=反应物的键能-生成物的键能=945KJ+3×436-2×3×391KJ=-93KJ<0,所以该反应是放热反应,
故答案为:放热;
(2)Q=反应物的键能-生成物的键能=945KJ+3×436-2×3×391KJ=-93KJ,即放出93KJ热量
故答案为:93kJ;
(3)Q1的数值是按完全转化计算出来的,而合成氨是可逆反应,开始时加入的1molN2和3 molH2不能完全反应生成2molNH3,因而放出热量小于93 kJ,所以,Q1<Q2,
故答案为:B.
点评 本题考查了键能与反应热的关系,形成化学键放出能量,破坏化学键吸收能量,反应热=形成化学键放出能量-破坏化学键吸收能量,题目难度不大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
7.向甲烷与丙炔的混合气体中加入一氧化碳气体,不论加入一氧化碳的体积如何改变,混合气体的密度始终不会改变(同温同压),则甲烷与丙炔的体积比是( )
| A. | 1:1 | B. | 4:3 | C. | 3:2 | D. | 3:4 |
5.下列实验装置与目的不相符的是( )
| A. |  向容量瓶中转移液体 | B. |  蒸干NH4Cl饱和溶液制备NH4Cl晶体 | ||
| C. |  中和热的测定 | D. |  分离四氯化碳和水 |
12.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 甲烷的结构式:CH4 | B. | NH4Cl的电子式: | ||
| C. | 苯的实验式:CH | D. | 乙烯的结构简式:C2H4 |
2.下列化学用语的表示正确的是( )
| A. | 过氧化钠电子式: | |
| B. | 质子数35、中子数45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子结构示意图: | |
| D. | HClO的结构式:H-Cl-O |
7.唐末五代时期丹学著作《真元妙道要略》中有云“以硫磺、雄黄合硝石并蜜烧之,焰起烧手面及烬屋舍者”.描述的是( )的制作过程.
| A. | 铝热剂 | B. | 黑火药 | C. | 木炭 | D. | 丹药(硫化汞) |
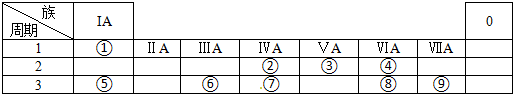
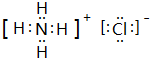 ,化学键类型有离子键、极性键(填“离子键”“极性键”或“非极性键”).
,化学键类型有离子键、极性键(填“离子键”“极性键”或“非极性键”). .
. .
.