题目内容
根据表提供的数据,下列判断正确的是( )
| 弱酸化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、等物质的量的Na2CO3和CH3COOH两种溶液混合,一定 有:c(Na+)+c(H+)=2c(CO32-)+c (HCO3-)+c (CH3COO-) |
| B、常温下,已知酸H2A存在如下平衡:H2A?H++HA-;HA-?H++A2-(Ka1=5.9xl0-2,Ka2=6.4xl0'6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 |
| C、相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c (Na+)>c (ClO-)>c (CH3COO-)>c (OH-)>c (H+) |
| D、常温下,在O.lmol/LCH3COOH溶液中滴加O.lmol/LNaOH的溶液发生反应,当c(CH3COOH):c (CH3COO-)=5:9时,此时溶液pH=5 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.根据溶液中的电荷守恒分析;
B.由Ka2可知,NaHA溶液显酸性,会抑制水的电离;
C.相同浓度的CHgCOONa和NaClO混合溶液中,ClO-的水解程度大于CH3COO-;
D.根据Ka=
计算c(H+)和pH.
B.由Ka2可知,NaHA溶液显酸性,会抑制水的电离;
C.相同浓度的CHgCOONa和NaClO混合溶液中,ClO-的水解程度大于CH3COO-;
D.根据Ka=
| c(H+)×c(CH3COO-) |
| c(CH3COOH) |
解答:
解:A.等物质的量的Na2CO3和CH3COOH两种溶液混合,溶液中的电荷守恒为c(Na+)+c(H+)=2c(CO32-)+c (HCO3-)+c (CH3COO-)+c(OH-),故A错误;
B.已知酸H2A的电离平衡常数Ka2=6.4xl0-6,则NaHA在溶液中以电离为主,则溶液显酸性,会抑制水的电离,所以NaHA溶液中水的电离程度一定小于纯水中水的电离程度,故B错误;
C.相同浓度的CHgCOONa和NaClO混合溶液中,ClO-的水解程度大于CH3COO-,则c (CH3COO-)>c (ClO-),所以溶液中离子浓度关系为c (Na+)>c (CH3COO-)>c (ClO-)>c (OH-)>c (H+),故C错误;
D.已知CH3COOH的电离常数为Ka=1.8×10-5,常温下,在O.lmol/LCH3COOH溶液中滴加O.lmol/LNaOH的溶液发生反应,当c(CH3COOH):c (CH3COO-)=5:9时,Ka=
=1.8×10-5,则c(H+)=10-5mol/L,pH=5,故D正确.
故选D.
B.已知酸H2A的电离平衡常数Ka2=6.4xl0-6,则NaHA在溶液中以电离为主,则溶液显酸性,会抑制水的电离,所以NaHA溶液中水的电离程度一定小于纯水中水的电离程度,故B错误;
C.相同浓度的CHgCOONa和NaClO混合溶液中,ClO-的水解程度大于CH3COO-,则c (CH3COO-)>c (ClO-),所以溶液中离子浓度关系为c (Na+)>c (CH3COO-)>c (ClO-)>c (OH-)>c (H+),故C错误;
D.已知CH3COOH的电离常数为Ka=1.8×10-5,常温下,在O.lmol/LCH3COOH溶液中滴加O.lmol/LNaOH的溶液发生反应,当c(CH3COOH):c (CH3COO-)=5:9时,Ka=
| c(H+)×c(CH3COO-) |
| c(CH3COOH) |
故选D.
点评:本题考查了弱电解质的电离、电离平衡常数的计算、溶液中离子浓度相比较等,侧重于基础知识的综合应用的考查,题目难度中等.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
下列有关化学用语正确的是( )
A、O原子的轨道表示式为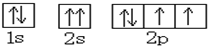 |
B、H2O的电子式为 |
| C、Ca原子的电子排布式为 1s22s22p63s23p63d2 |
D、K原子的原子结构示意图为 |
下列说法中正确的一组是( )
| A、H2和D2互为同位素 |
B、 和 和 互为同分异构体 互为同分异构体 |
| C、H、D、T互称为同素异形体 |
D、 和 和 是同一种物质 是同一种物质 |
 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌“一滴香”的分子结构如图所示,下列说法正确的是( )| A、该有机物的分子式为C7H6O3 |
| B、1mol该有机物最多能与2molH2发生加成反应 |
| C、该有机物能发生取代、加成和氧化反应 |
| D、该有机物的一种芳香族同分异构体能发生眼镜反应 |
下列能发生消去反应的是( )
| A、1-溴丙烷与NaOH醇溶液共热 |
| B、乙醇与浓H2SO4共热至140℃ |
| C、溴乙烷与NaOH水溶液共热 |
| D、乙醇与NaOH醇溶液共热 |
 将反应5IO3-+I-+6H+?3I2+3H2O设计成如图所示的原电池.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流 计指针再次发生偏转.下列判断不正确的是( )
将反应5IO3-+I-+6H+?3I2+3H2O设计成如图所示的原电池.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流 计指针再次发生偏转.下列判断不正确的是( )| A、开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应 |
| B、开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝 |
| C、电流计读数为零时,反应达到化学平衡状态 |
| D、两次电流计指针偏转方向相反 |
下列各组离子中,能在强酸性溶液中大量共存的是( )
| A、Na+、K+、SO42-、OH- |
| B、Na+、K+、Cl-、HCO3- |
| C、Na+、Cu2+、CO32-、Br- |
| D、Na+、Mg2+、NO3-、Cl- |
下列有关物质制取或性质探究实验设计不能达到实验目的是( )


| A、利用图1制取并收集干燥的氨气 |
| B、利用图2制取Fe(OH)2,使用煤油的目的是防止生成的Fe(OH)2被空气氧化 |
| C、利用图3制取并收集NO2气体 |
| D、利用图4用酒精制取无水乙醇 |