题目内容
短周期元素X、Y、Z原子序数依次递增.X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,X、Z在同一主族.
(1)Z元素在周期表中的位置是 .
(2)X、Y、Z三种元素简单离子半径大小的顺序为 (用离子符号表示).
(3)Y2ZX3溶液显 性,能证明该溶液中存在水解平衡的事实是 (填序号)
a.滴入酚酞溶液变红,再加入稀H2SO4红色褪去
b.滴入酚酞溶液变红,再加入氯水红色褪去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色褪去
(4)化合物FeZ2和FeX可发生如下转化(部分产物和条件略去)
FeZ2
澄清滤液
沉淀
FeX
①FeZ2与稀硫酸反应的化学方程式是
②隔绝空气的条件下,若向刚生成的沉淀中通入HCl,可能观察到的现象 ,反应的离子方程式
(5)某草酸盐晶体KxFey(C2O4)z.wH20中铁为+3价,草酸根为-2价,且知x+y+z=7. 取该晶体做了以下实验:
a.取4.910g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
加热到300℃以上时,还生成了一种不常见的碳的氧化物气体(用R表示);
b.另取4.910g晶体,经过加酸溶解、加足量碱沉淀、灼烧至恒重,铁元素全部转化为 Fe2O3,质量为 O.800g
①草酸盐晶体中结晶水的质量分数为 (保留三位小数);
②R的化学式为 ;
③确定草酸盐晶体的化学式 .
(1)Z元素在周期表中的位置是
(2)X、Y、Z三种元素简单离子半径大小的顺序为
(3)Y2ZX3溶液显
a.滴入酚酞溶液变红,再加入稀H2SO4红色褪去
b.滴入酚酞溶液变红,再加入氯水红色褪去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色褪去
(4)化合物FeZ2和FeX可发生如下转化(部分产物和条件略去)
FeZ2
| 稀硫酸 |
| 足量NaOH |
| 蒸干、灼烧 |
| 一定条件 |
①FeZ2与稀硫酸反应的化学方程式是
②隔绝空气的条件下,若向刚生成的沉淀中通入HCl,可能观察到的现象
(5)某草酸盐晶体KxFey(C2O4)z.wH20中铁为+3价,草酸根为-2价,且知x+y+z=7. 取该晶体做了以下实验:
a.取4.910g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
| 120℃ | 300℃ | 480℃ | |
| 化学式 | KxFey(C2O4)Z | KxFeyO(C2O4)Z-1 | KxFeyO2(C2O4)Z-2 |
| 质量 | 4.370g | 3.650g | 2.930g |
b.另取4.910g晶体,经过加酸溶解、加足量碱沉淀、灼烧至恒重,铁元素全部转化为 Fe2O3,质量为 O.800g
①草酸盐晶体中结晶水的质量分数为
②R的化学式为
③确定草酸盐晶体的化学式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素X、Y、Z原子序数依次递增,X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,则Y只能是Na元素;X、Z在同一主族,X和Z最外层电子数之和为12,则X为O、Z为S元素;
(1)主族元素原子核外电子层数与其周期数相等、最外层电子数与其族序数相等,据此确定Z元素在周期表中的位置;
(2)原子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(3)Na2SO3溶液显碱性,亚硫酸钠和氯化钡反应生成亚硫酸钡沉淀,从而抑制亚硫酸根离子水解;
(4)①FeS2与稀硫酸反应生成硫酸亚铁和硫化氢、S;
②隔绝空气的条件下,生成的白色沉淀是氢氧化亚铁,若向刚生成的沉淀中通入HCl,氢氧化亚铁溶于稀盐酸生成氯化亚铁;
(5)①加热120℃时得到KxFey(C2O4)Z,完全失去KxFey(C2O4)Z?wH2O中结晶水,计算结晶水的质量,进而计算结晶水的质量分数;
②结合化学式KxFey(C2O4)Z?wH2O、300℃时物质的化学式,根据原子守恒确定R的化学式;
③根据质量守恒,计算300℃时生成R的质量,根据反应方程式进而计算KxFey(C2O4)Z?wH2O的物质的量,再根据M=
计算其摩尔质量;
根据Fe元素守恒计算晶体中y的值,结合电荷守恒、x+y+z=7计算x、z的值,结合晶体相对分子质量计算w的值,进而确定晶体的化学式.
(1)主族元素原子核外电子层数与其周期数相等、最外层电子数与其族序数相等,据此确定Z元素在周期表中的位置;
(2)原子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(3)Na2SO3溶液显碱性,亚硫酸钠和氯化钡反应生成亚硫酸钡沉淀,从而抑制亚硫酸根离子水解;
(4)①FeS2与稀硫酸反应生成硫酸亚铁和硫化氢、S;
②隔绝空气的条件下,生成的白色沉淀是氢氧化亚铁,若向刚生成的沉淀中通入HCl,氢氧化亚铁溶于稀盐酸生成氯化亚铁;
(5)①加热120℃时得到KxFey(C2O4)Z,完全失去KxFey(C2O4)Z?wH2O中结晶水,计算结晶水的质量,进而计算结晶水的质量分数;
②结合化学式KxFey(C2O4)Z?wH2O、300℃时物质的化学式,根据原子守恒确定R的化学式;
③根据质量守恒,计算300℃时生成R的质量,根据反应方程式进而计算KxFey(C2O4)Z?wH2O的物质的量,再根据M=
| m |
| n |
根据Fe元素守恒计算晶体中y的值,结合电荷守恒、x+y+z=7计算x、z的值,结合晶体相对分子质量计算w的值,进而确定晶体的化学式.
解答:
解:短周期元素X、Y、Z原子序数依次递增,X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,则Y只能是Na元素;X、Z在同一主族,X和Z最外层电子数之和为12,则X为O、Z为S元素;
(1)主族元素原子核外电子层数与其周期数相等、最外层电子数与其族序数相等,S原子核外有3个电子层、最外层有6个电子,所以Z位于第三周期第VIA族,
故答案为:第三周期第VIA族;
(2)原子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以这三种元素离子半径顺序是Na+<O2-<S2-,
故答案为:Na+<O2-<S2-;
(3)Na2SO3是强碱弱酸盐,亚硫酸根离子水解导致溶液显碱性,亚硫酸钠和氯化钡反应生成亚硫酸钡沉淀,从而抑制亚硫酸根离子水解,加有酚酞的试液褪色,故答案为:碱;C;
(4)①FeS2与稀硫酸反应生成硫酸亚铁和硫化氢、S,反应方程式为FeS2+H2SO4=FeSO4+S↓+H2S↑,故答案为:FeS2+H2SO4=FeSO4+S↓+H2S↑;
②隔绝空气的条件下,生成的白色沉淀是氢氧化亚铁,若向刚生成的沉淀中通入HCl,氢氧化亚铁溶于稀盐酸生成氯化亚铁,溶液变为浅绿色,所以看到的现象是:白色沉淀溶解、溶液变浅绿色,离子方程式为Fe(OH)2+3H+=2Fe3++2H2O,
故答案为:白色沉淀溶解、溶液变浅绿色;Fe(OH)2+3H+=2Fe3++2H2O;
(5)①加热120℃时得到KxFey(C2O4)Z,完全失去KxFey(C2O4)Z?wH2O中结晶水,结晶水的质量为4.91g-4.37g=0.54g,晶体中结晶水的质量分数为
×100%≈11.0%,
故答案为:11.0%;
②结合化学式KxFey(C2O4)Z?wH2O、300℃时物质的化学式为KxFeyO(C2O4)Z-1,根据原子守恒,R中C原子数目为2,O原子数目为4-1=3,故R的化学式为:C2O3,
故答案为:C2O3;
③根据质量守恒,300℃时生成C2O3的质量质量为4.37g-3.65g=0.72g,其物质的量为
=0.01mol,由KxFey(C2O4)Z?wH2O=KxFey(C2O4)Z+C2O3+wH2O,可知KxFey(C2O4)Z?wH2O的物质的量为0.01mol,故KxFey(C2O4)Z?wH2O的摩尔质量为
=491g/mol,
根据Fe元素守恒,0.01mol×y=
×2,则y=1,由x+y+z=7,则x+z=6,由电荷守恒可知x+3=2z,联立方程解得x=3,z=3,故w=
=3,故该草酸盐晶体的化学式为:K3Fe(C2O4)3?3H2O,
故答案为:K3Fe(C2O4)3?3H2O.
(1)主族元素原子核外电子层数与其周期数相等、最外层电子数与其族序数相等,S原子核外有3个电子层、最外层有6个电子,所以Z位于第三周期第VIA族,
故答案为:第三周期第VIA族;
(2)原子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以这三种元素离子半径顺序是Na+<O2-<S2-,
故答案为:Na+<O2-<S2-;
(3)Na2SO3是强碱弱酸盐,亚硫酸根离子水解导致溶液显碱性,亚硫酸钠和氯化钡反应生成亚硫酸钡沉淀,从而抑制亚硫酸根离子水解,加有酚酞的试液褪色,故答案为:碱;C;
(4)①FeS2与稀硫酸反应生成硫酸亚铁和硫化氢、S,反应方程式为FeS2+H2SO4=FeSO4+S↓+H2S↑,故答案为:FeS2+H2SO4=FeSO4+S↓+H2S↑;
②隔绝空气的条件下,生成的白色沉淀是氢氧化亚铁,若向刚生成的沉淀中通入HCl,氢氧化亚铁溶于稀盐酸生成氯化亚铁,溶液变为浅绿色,所以看到的现象是:白色沉淀溶解、溶液变浅绿色,离子方程式为Fe(OH)2+3H+=2Fe3++2H2O,
故答案为:白色沉淀溶解、溶液变浅绿色;Fe(OH)2+3H+=2Fe3++2H2O;
(5)①加热120℃时得到KxFey(C2O4)Z,完全失去KxFey(C2O4)Z?wH2O中结晶水,结晶水的质量为4.91g-4.37g=0.54g,晶体中结晶水的质量分数为
| 0.54g |
| 4.91g |
故答案为:11.0%;
②结合化学式KxFey(C2O4)Z?wH2O、300℃时物质的化学式为KxFeyO(C2O4)Z-1,根据原子守恒,R中C原子数目为2,O原子数目为4-1=3,故R的化学式为:C2O3,
故答案为:C2O3;
③根据质量守恒,300℃时生成C2O3的质量质量为4.37g-3.65g=0.72g,其物质的量为
| 0.72g |
| 72g/mol |
| 4.91g |
| 0.01mol |
根据Fe元素守恒,0.01mol×y=
| 0.8g |
| 180g/mol |
| 491-39×9-88×3 |
| 18 |
故答案为:K3Fe(C2O4)3?3H2O.
点评:本题考查位置结构性质关系,侧重考查分析计算能力,涉及复杂化学式的确定、元素周期律、盐类水解、氧化还原反应等知识点,这些都是高考高频点,难点是复杂化学式的确定,要结合原子守恒进行计算,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列判断错误的是( )
| A、沸点:NH3>PH3>AsH3 |
| B、熔点:Li>Na>K |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
根据表提供的数据,下列判断正确的是( )
| 弱酸化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、等物质的量的Na2CO3和CH3COOH两种溶液混合,一定 有:c(Na+)+c(H+)=2c(CO32-)+c (HCO3-)+c (CH3COO-) |
| B、常温下,已知酸H2A存在如下平衡:H2A?H++HA-;HA-?H++A2-(Ka1=5.9xl0-2,Ka2=6.4xl0'6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 |
| C、相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c (Na+)>c (ClO-)>c (CH3COO-)>c (OH-)>c (H+) |
| D、常温下,在O.lmol/LCH3COOH溶液中滴加O.lmol/LNaOH的溶液发生反应,当c(CH3COOH):c (CH3COO-)=5:9时,此时溶液pH=5 |
下列实验过程中,溶液的pH增大的是( )
| A、向NaOH溶液中滴加水 |
| B、向稀盐酸中滴加NaOH溶液 |
| C、向NaCl溶液中滴加稀盐酸 |
| D、向NaOH溶液中滴加稀盐酸 |
下列说法正确的是( )


| A、按系统命名法命名时,(图1)化合物的名称是2,4,6-三甲基-5-乙基庚烷 |
| B、有机物(图2)的一种芳香族同分异构体能发生银镜反应 |
| C、高分子化合物(图3),其单体为对苯二甲酸和乙醇 |
| D、等质量的乙炔和苯完全燃烧生成水的质量相等 |
下列关于实验的说法正确的是( )
| A、将二氧化碳通人硅酸钠溶液以证明碳酸的酸性比硅酸强 |
B、如图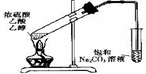 装置中,导管不能伸人液面的原因是产物易溶于水 装置中,导管不能伸人液面的原因是产物易溶于水 |
| C、用碱石灰可干燥氯气 |
| D、用普通玻璃棒蘸取溶液做焰色反应以证明溶液含有Na十 |
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原于有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同,D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原于有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同,D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25. 铝及其化合物用途广泛
铝及其化合物用途广泛