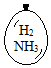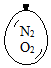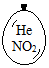题目内容
16. 25℃时,三种酸的电离平衡常数如表所示.
25℃时,三种酸的电离平衡常数如表所示.| 化学式 | CH3COOH | HClO | H3PO3 |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平衡常数(25℃) | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
(1)亚磷酸(H3PO3) 为二元中强酸,具有较强的还原性,可将银离子还原成银单质,在空气可缓慢氧化成H3PO4.H3PO3的电离方程式为H3PO3?H2PO3-+H+(H2PO3-?HPO32-+H+).
(2)物质的量浓度均为0.1mol•L-1的三种溶液:a.CH3COONa b.NaClO c.NaHPO3
它们的pH由小到大排列顺序是b>c>a(用字母表示).
(3)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是A(填字母).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(4)体积为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.
分析 (1)亚磷酸(H3PO3) 为二元中强酸,分步电离且电离可逆;
(2)据三种酸的电离平衡常数判断酸性强弱,越弱越水解;
(3)CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,c(OH-)增大,Kw不变;
(4)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大.
解答 解:(1)亚磷酸(H3PO3) 为二元中强酸,分步电离且电离可逆,电离方程式为H3PO3?H2PO3-+H+ (H2PO3-?HPO32-+H+),
故答案为:H3PO3?H2PO3-+H+ (H2PO3-?HPO32-+H+);
(2)据电离平衡常数可知,三种酸由强到弱的顺序为亚磷酸、醋酸、次氯酸,越弱越水解,所以物质的量浓度均为0.1mol•L-1的三种溶液:a.CH3COONa b.NaClO c.NaHPO3它们的pH由小到大排列顺序是b>c>a,故答案为:b>c>a;
(3)A.CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,故A选;
B.c(H+)/c(CH3COOH)=n(H+)/n(CH3COOH),则稀释过程中比值变大,故B不选;
C.稀释过程,促进电离,c(H+)减小,c(OH-)增大,c(H+)•c(OH-)=Kw,Kw不变,故C不选;
D.稀释过程,促进电离,c(H+)减小,c(OH-)增大,则c(OH-)/c(H+)变大,故D不选;
故答案为:A;
(4)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;
故答案为:大于.
点评 本题考查电解质溶液之间的反应,涉及到弱电解质的电离、盐类的水解及溶液的pH值、离子浓度大小的比较等知识,解题时要善于利用溶质物质的量的变化去分析.

练习册系列答案
相关题目
6.Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2.某小组设计了如图实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2.回答下列问题:
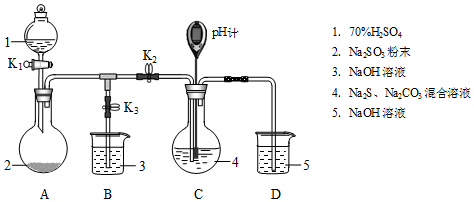
(1)装置A的作用是制备SO2,反应的化学方程式为H2SO4+Na2SO3=SO2↑+H2O+Na2SO4.
(2)完成表实验过程:
(3)Na2S2O3有还原性,可作脱氯剂.向Na2S2O3溶液中通入少量Cl2,某同学预测S2O32-转变为SO42-,设计实验验证该预测:取少量反应后的溶液于试管中,加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成.

(1)装置A的作用是制备SO2,反应的化学方程式为H2SO4+Na2SO3=SO2↑+H2O+Na2SO4.
(2)完成表实验过程:
| 操作步骤 | 装置C的实验现象 | 解释原因 |
| 检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): S2-+H2O?HS-+OH- |
| 打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出,溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少); ⅱ.pH计读数逐渐 减小 | 反应分步进行: Na2CO3+SO2═Na2SO3+CO2 2Na2S+3SO2═2Na2SO3+3S↓ Na2SO3+S═Na2S2O3(较慢) |
| 当pH计读数接近7时,立即停止通SO2,操作是关闭K1、K2,打开K3 | / | 必须立即停止通SO2的原因是: SO2过量会使溶液酸度增加,使产物分解,降低产率 |
4.下列关于氯气及氯水的说法不.正.确.的是( )
| A. | 氯水加入有色布条后,有色布条褪色,说明氯水中有 HClO 分子存在 | |
| B. | 制取漂白液的离子方程式是:Cl2+2OH-═Cl-+ClO-+H2O,该反应的氧化剂与还原剂的物质的量之比为 1:1 | |
| C. | 1mol Cl2 与足量 Fe 反应,转移的电子的物质的量为 3 mol | |
| D. | 向某铁盐溶液中滴入 KSCN 溶液,无明显现象,加入氯水,溶液显血红色,说明原溶液中含有 Fe2+ |
11.如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已 略).

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.装置 B 中饱和食盐水的作用是;
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入④(填编号)
(3)装置 F 中用足量的 NaOH 溶液吸收余氯,试写出相应的离子方程式2OH-+Cl2=Cl-+ClO-+H2O.
(4)如果将二氧化锰与足量的浓盐酸混合加热,若有17.4g 的 MnO2 被还原,则被氧化的 HCl 的质量为7.3g.
(5)向 Na2CO3 溶液中通入氯气,可制得某种生产和生活中常用于漂白、消毒的 物质,同时有 NaHCO3 生成,该反应的化学方程式是2Na2CO3+Cl2+H2O=2NaHCO3+NaCl+NaClO.

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.装置 B 中饱和食盐水的作用是;
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入④(填编号)
| ① | ② | ③ | ④ | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)如果将二氧化锰与足量的浓盐酸混合加热,若有17.4g 的 MnO2 被还原,则被氧化的 HCl 的质量为7.3g.
(5)向 Na2CO3 溶液中通入氯气,可制得某种生产和生活中常用于漂白、消毒的 物质,同时有 NaHCO3 生成,该反应的化学方程式是2Na2CO3+Cl2+H2O=2NaHCO3+NaCl+NaClO.
1.下列说法不正确的是( )
| A. | 芳香烃的获取主要来自煤的干馏和对石油分馏产品的催化重整 | |
| B. | 正丁烷转化为异丁烷一定有能量变化 | |
| C. | 石油的催化裂化主要目的是提高轻质液体燃料的产量尤其是汽油的产量 | |
| D. | 石油的常压分馏能得到润滑油、石蜡等 |
8.相同状况下,1.12L乙烷和丁烷的混合物完全燃烧需O2 4.76L,则混合气中乙烷的体积分数是( )
| A. | 25% | B. | 35% | C. | 65% | D. | 75% |
5.下列实验操作和现象,得出的结论正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用湿润的蓝色石蕊试纸检验某气体 | 试纸变红 | 气体呈碱性 |
| B | 铁粉中加入新制氯水,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 铁粉被氧化成Fe3+ |
| C | 向Mg(OH)2的上层清液中滴加MgCl2溶液 | 沉淀变成白色 | Qc[Mg(OH)2]<Ksp[Mg(OH)2] |
| D | 将少量溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CC14,振荡静置 | 下层分别为无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
6.Na+的浓度不是1mol/L的溶液是( )
| A. | 0.5mol/L的NaCl | B. | 0.5 mol/L的Na2SO4 | ||
| C. | 1mol/L的NaOH | D. | 0.5 mol/L的Na2CO3 |
 在同温同压下,向大小相同的气球分别充入CO和以下四种混合气体,当体积相等时A、B、C、D四个气球内,与充入CO气球内所含原子数一定相等的是( )
在同温同压下,向大小相同的气球分别充入CO和以下四种混合气体,当体积相等时A、B、C、D四个气球内,与充入CO气球内所含原子数一定相等的是( )