题目内容
1.下列说法不正确的是( )| A. | 芳香烃的获取主要来自煤的干馏和对石油分馏产品的催化重整 | |
| B. | 正丁烷转化为异丁烷一定有能量变化 | |
| C. | 石油的催化裂化主要目的是提高轻质液体燃料的产量尤其是汽油的产量 | |
| D. | 石油的常压分馏能得到润滑油、石蜡等 |
分析 A、煤的干馏和石油的催化重整均可以获得芳香烃;
B、正丁烷转化为异丁烷为化学变化;
C、石油的催化裂化的目的是获得轻质油;
D、润滑油和石蜡均为石油的减压分馏的产物.
解答 解:A、煤的干馏和石油的催化重整均可以获得芳香烃,即工业上芳香烃的重要来源是石油的催化重整和煤的干馏,故A正确;
B、正丁烷转化为异丁烷为化学变化,而化学变化一定伴随着能量的变化,正丁烷转化为异丁烷一定有能量的变化,故B正确;
C、石油的催化裂化的目的是获得轻质油,提高轻质油特别是汽油的产量,故C正确;
D、润滑油和石蜡均为石油的减压分馏的产物,汽油的常压分馏的产物有液化石油气、汽油、煤油、柴油等,故D错误.
故选D.
点评 本题考查了煤和石油的综合利用,难度不大,应注意的是石油的裂化的目的是获得轻质油,裂解的目的是获得乙烯,催化重整的目的是获得芳香烃.

练习册系列答案
相关题目
11.化学与生产、生活密切相关.下列有关说法不正确的是( )
| A. | 浓硫酸可作干燥剂 | B. | SO2可作食品的漂白剂 | ||
| C. | 漂白液可作环境的消毒剂 | D. | KAl(SO4)2•12H2O可作净水剂 |
12.下列叙述正确的是( )
| A. | 在熔融状态下,1molNa2O2完全电离出的离子数目为4 NA | |
| B. | 常温下,0.05molCO2和SO2混合气体中所含氧原子数为0.1 NA | |
| C. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| D. | 0.1 mol MnO2与足量的浓盐酸加热反应生成Cl2的体积约为2.24 L |
9.将 ag 铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加 反应的 HCl 为 0.08mol,放出标准状况下的气体 0.224L.则下列判断中正确的是( )
| A. | 此时溶液中 Fe2+和 Fe3+的物质的量之比为 3:1 | |
| B. | 向溶液中滴入 KSCN 溶液,显血红色 | |
| C. | 无法计算原混合物的质量 | |
| D. | 原混合物中 n(Fe):n(Fe2O3)=2:1 |
16.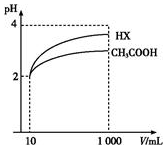 25℃时,三种酸的电离平衡常数如表所示.
25℃时,三种酸的电离平衡常数如表所示.
回答下列问题:
(1)亚磷酸(H3PO3) 为二元中强酸,具有较强的还原性,可将银离子还原成银单质,在空气可缓慢氧化成H3PO4.H3PO3的电离方程式为H3PO3?H2PO3-+H+(H2PO3-?HPO32-+H+).
(2)物质的量浓度均为0.1mol•L-1的三种溶液:a.CH3COONa b.NaClO c.NaHPO3
它们的pH由小到大排列顺序是b>c>a(用字母表示).
(3)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是A(填字母).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(4)体积为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.
 25℃时,三种酸的电离平衡常数如表所示.
25℃时,三种酸的电离平衡常数如表所示.| 化学式 | CH3COOH | HClO | H3PO3 |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平衡常数(25℃) | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
(1)亚磷酸(H3PO3) 为二元中强酸,具有较强的还原性,可将银离子还原成银单质,在空气可缓慢氧化成H3PO4.H3PO3的电离方程式为H3PO3?H2PO3-+H+(H2PO3-?HPO32-+H+).
(2)物质的量浓度均为0.1mol•L-1的三种溶液:a.CH3COONa b.NaClO c.NaHPO3
它们的pH由小到大排列顺序是b>c>a(用字母表示).
(3)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是A(填字母).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(4)体积为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.
6.间甲乙苯苯环上的一个氢原子被-C3H7Cl取代,形成的同分异构体有(不考虑立体异构)( )
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 20种 |
13.取三个干燥的烧瓶,分别装入标准状况下的干燥氨气、含有二分之一体积空气的氯化氢、二氧化氮和氧气(体积比为4:1)的混合气体;然后分别做溶解于水的喷泉实验.实验结束后三个烧瓶中所得溶液的物质的量浓度之比为( )
| A. | 2:1:2 | B. | 1:1:1 | C. | 5:5:4 | D. | 7:7:4 |
10.下列对实验室突发事件的处理,合理的是( )
| A. | 日光灯管破碎,只需收集散落的汞即可 | |
| B. | 金属镁失火,应采用泡沫灭火器灭火 | |
| C. | 钡离子中毒,可以通过服用碳酸钠溶液解毒 | |
| D. | 烧碱溶液溅到皮肤上,应立即用大量的水冲洗 |
11.实验现象描述错误的是( )
| A. | 碘单质受热升华:紫色蒸气 | B. | 硫磺在氧气中燃烧:蓝紫色的火焰 | ||
| C. | 铁丝在氯气中燃烧:棕褐色的烟 | D. | 氢气在氯气中燃烧:淡蓝色火焰 |