题目内容
7.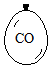 在同温同压下,向大小相同的气球分别充入CO和以下四种混合气体,当体积相等时A、B、C、D四个气球内,与充入CO气球内所含原子数一定相等的是( )
在同温同压下,向大小相同的气球分别充入CO和以下四种混合气体,当体积相等时A、B、C、D四个气球内,与充入CO气球内所含原子数一定相等的是( )| A. |  | B. | 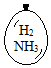 | C. | 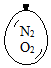 | D. | 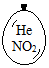 |
分析 相同条件下,气体的气体摩尔体积相同,由n=$\frac{V}{{V}_{m}}$可知气体的物质的量相同,假设CO为1mol,则含有2mol原子,如原子数相等,则原子物质的量相等,据此分析.
解答 解:A.含有HCl和O3,1mol混合气体含有的原子的物质的量大于2mol,故A错误;
B.含有H2和NH3,二者原子的物质的量大于2mol,故B错误;
C.含有N2和O2,都为双原子分子,则1mol混合气体含有2mol原子,故C正确;
D.含有Ne和NO2,二者的物质的量比为1:1时才符合,故D错误.
故选C.
点评 本题考查物质的量的计算,侧重于学生的分析能力和计算能力的考查,注意相关计算公式的运用以及物质的构成的判断,难度不大.

练习册系列答案
相关题目
18.向KOH溶液中通入11.2L(标准状况)氯气恰好完全反应生成三种含氯盐:0.7molKCl、0.2molKClO和X.则X是( )
| A. | 0.1molKClO4 | B. | 0.1molKClO3 | C. | 0.2molKClO2 | D. | 0.1molKClO2 |
18.下列实验“操作和现象”与“结论”对应关系正确的是( )
| A. | 向盛有某溶液的试管中加入盐酸酸化的硝酸钡,产生白色沉淀,则该溶液中一定含SO42- | |
| B. | 向盛有某溶液的试管中加入浓的强碱溶液,加热,用润湿的蓝色石蕊试纸置于管口,试纸变红,则该溶液中一定含有NH4+ | |
| C. | 向盛有某溶液的试管中加入硝酸银溶液,产生了白色沉淀,则该溶液中一定含有Cl- | |
| D. | 向盛有某溶液的试管中加入加入KSCN溶液显红色.则该溶液中一定含有Fe3+ |
2.饱和氯水长期放置后,下列微粒在溶液中不减少的是( )
| A. | HClO | B. | Cl- | C. | Cl2 | D. | ClO- |
12.下列叙述正确的是( )
| A. | 在熔融状态下,1molNa2O2完全电离出的离子数目为4 NA | |
| B. | 常温下,0.05molCO2和SO2混合气体中所含氧原子数为0.1 NA | |
| C. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| D. | 0.1 mol MnO2与足量的浓盐酸加热反应生成Cl2的体积约为2.24 L |
19.化学与科学、技术、社会、环境密切相关,下列有关说法中错误的是( )
| A. | 2010 年 11 月广州亚运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 合金的硬度一般比它的各成分金属的小,多数合金的熔点一般也比它的各成分金属 的高 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
16. 25℃时,三种酸的电离平衡常数如表所示.
25℃时,三种酸的电离平衡常数如表所示.
回答下列问题:
(1)亚磷酸(H3PO3) 为二元中强酸,具有较强的还原性,可将银离子还原成银单质,在空气可缓慢氧化成H3PO4.H3PO3的电离方程式为H3PO3?H2PO3-+H+(H2PO3-?HPO32-+H+).
(2)物质的量浓度均为0.1mol•L-1的三种溶液:a.CH3COONa b.NaClO c.NaHPO3
它们的pH由小到大排列顺序是b>c>a(用字母表示).
(3)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是A(填字母).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
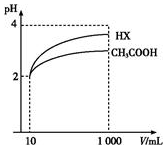
(4)体积为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.
 25℃时,三种酸的电离平衡常数如表所示.
25℃时,三种酸的电离平衡常数如表所示.| 化学式 | CH3COOH | HClO | H3PO3 |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平衡常数(25℃) | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
(1)亚磷酸(H3PO3) 为二元中强酸,具有较强的还原性,可将银离子还原成银单质,在空气可缓慢氧化成H3PO4.H3PO3的电离方程式为H3PO3?H2PO3-+H+(H2PO3-?HPO32-+H+).
(2)物质的量浓度均为0.1mol•L-1的三种溶液:a.CH3COONa b.NaClO c.NaHPO3
它们的pH由小到大排列顺序是b>c>a(用字母表示).
(3)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是A(填字母).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(4)体积为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.
17.X、Y、Z、W、Q五种短周期元素在元素周期表中的位置如表所示,其中X元素原子的最外层电子数是最内层电子数的3倍,则下列说法一定正确的是( )
| X | Y | |
| Z | W | Q |
| A. | X、W能分别与钠形成摩尔质量相同且阴、阳离子个数比为1:2的化合物 | |
| B. | X和Z只能形成一种化合物 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |