题目内容
6.Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2.某小组设计了如图实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2.回答下列问题: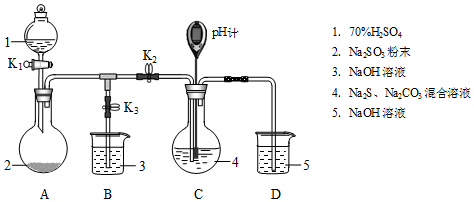
(1)装置A的作用是制备SO2,反应的化学方程式为H2SO4+Na2SO3=SO2↑+H2O+Na2SO4.
(2)完成表实验过程:
| 操作步骤 | 装置C的实验现象 | 解释原因 |
| 检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): S2-+H2O?HS-+OH- |
| 打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出,溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少); ⅱ.pH计读数逐渐 减小 | 反应分步进行: Na2CO3+SO2═Na2SO3+CO2 2Na2S+3SO2═2Na2SO3+3S↓ Na2SO3+S═Na2S2O3(较慢) |
| 当pH计读数接近7时,立即停止通SO2,操作是关闭K1、K2,打开K3 | / | 必须立即停止通SO2的原因是: SO2过量会使溶液酸度增加,使产物分解,降低产率 |
分析 (1)装置A中试剂1为浓硫酸,试剂2为Na2SO3,反应生成二氧化硫气体;
(2)检查装置气密性后,添加药品,pH计读数约为13说明溶液显碱性是硫离子水解的原因;
打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下,反应分步进行:
Na2CO3+SO2═Na2SO3+CO2
2Na2S+3SO2═2Na2SO3+3S↓
Na2SO3+S═Na2S2O3(较慢)
发生总反应为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2 ,据此分析反应现象;
当pH计读数接近7时,立即停止通SO2,SO2过量会使溶液酸度增加,使产物分解,降低产率,操作是关闭K1、K2,打开K3;
(3)预测S2O32-转变为SO42-,可以利用检验硫酸根离子的方法设计实验检验;
解答 解:(1)装置A中试剂1为浓硫酸,试剂2为Na2SO3,反应生成二氧化硫气体,反应的化学方程式为:H2SO4+Na2SO3=SO2↑+H2O+Na2SO4,
故答案为:SO2; H2SO4+Na2SO3=SO2↑+H2O+Na2SO4;
(2)检查装置气密性后,添加药品,pH计读数约为13说明溶液显碱性是硫离子水解,水解离子方程式为:S2-+H2O?HS-+OH-,
打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下,反应分步进行:
Na2CO3+SO2═Na2SO3+CO2
2Na2S+3SO2═2Na2SO3+3S↓
Na2SO3+S═Na2S2O3(较慢)
发生总反应为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2 ,
反应过程中的现象是导管口有气泡冒出,溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少),碳酸钠溶液变化为亚硫酸钠溶液和硫代硫酸钠溶液,pH计读数逐渐减小
当pH计读数接近7时,立即停止通SO2,操作是关闭K1、K2,打开K3,必须立即停止通SO2的原因是:SO2过量会使溶液酸度增加,使产物分解,降低产率,
故答案为:S2-+H2O?HS-+OH-;溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少);减小;关闭K1、K2,打开K3;SO2过量会使溶液酸度增加,使产物分解,降低产率;
(3)Na2S2O3有还原性,可作脱氯剂.向Na2S2O3溶液中通入少量Cl2,某同学预测S2O32-转变为SO42-,设计实验为:取少量反应后的溶液于试管中,加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成,
故答案为:加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成;
点评 本题考查了物质制备、物质性质、实验过程的分析判断、反应现象和反应化学方程式的掌握、注意实验基本操作和物质性质是解题关键,题目难度中等.

| A. | 醋酸溶液的浓度大于盐酸溶液的浓度 | |
| B. | 相同体积的两溶液能中和等物质的量的氢氧化钠 | |
| C. | 两溶液稀释100倍,pH都为5 | |
| D. | 两溶液中分别加入少量对应的钠盐,c(H+) 均明显增大 |
| A. | 0.1molKClO4 | B. | 0.1molKClO3 | C. | 0.2molKClO2 | D. | 0.1molKClO2 |
| A. | 离子半径大小顺序:r(Z2+)>r(Y2-) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | 单质的熔点Z>W |
| A. | 简单离子半径:Z>Y>X | B. | 氢化物的稳定性:Z>X | ||
| C. | Z的最高价氧化物可用于漂白 | D. | X与Y形成的化合物为离子化合物 |
| A. | 浓硫酸可作干燥剂 | B. | SO2可作食品的漂白剂 | ||
| C. | 漂白液可作环境的消毒剂 | D. | KAl(SO4)2•12H2O可作净水剂 |
| A. | 向盛有某溶液的试管中加入盐酸酸化的硝酸钡,产生白色沉淀,则该溶液中一定含SO42- | |
| B. | 向盛有某溶液的试管中加入浓的强碱溶液,加热,用润湿的蓝色石蕊试纸置于管口,试纸变红,则该溶液中一定含有NH4+ | |
| C. | 向盛有某溶液的试管中加入硝酸银溶液,产生了白色沉淀,则该溶液中一定含有Cl- | |
| D. | 向盛有某溶液的试管中加入加入KSCN溶液显红色.则该溶液中一定含有Fe3+ |
 25℃时,三种酸的电离平衡常数如表所示.
25℃时,三种酸的电离平衡常数如表所示.| 化学式 | CH3COOH | HClO | H3PO3 |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平衡常数(25℃) | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
(1)亚磷酸(H3PO3) 为二元中强酸,具有较强的还原性,可将银离子还原成银单质,在空气可缓慢氧化成H3PO4.H3PO3的电离方程式为H3PO3?H2PO3-+H+(H2PO3-?HPO32-+H+).
(2)物质的量浓度均为0.1mol•L-1的三种溶液:a.CH3COONa b.NaClO c.NaHPO3
它们的pH由小到大排列顺序是b>c>a(用字母表示).
(3)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是A(填字母).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
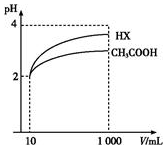
(4)体积为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.