题目内容
8.氮及其化合物在生产生活中有广泛应用.(1)已知:CO可将部分氮的氧化物还原为N2.
反应Ⅰ:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-746kJ•mol-1
反应Ⅱ:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H=-1200kJ•mol-1
写出CO将NO2还原为NO的热化学方程式CO(g)+NO2(g)?CO2(g)+NO(g)△H=-227 kJ•mol-1.
(2)在密闭容器中充入5mol CO和4mol NO,发生上述反应I,图1为平衡时NO的体积分数与温度、压强的关系.

回答下列问题:
①温度:T1>T2(填“<”或“>”).
②某温度下,在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,用CO的浓度变化表示的平均反应速率v(CO)=0.05 mol•L-1•min-1.
③某温度下,反应达到平衡状态D点时,容器体积为2L,此时的平衡常数K=0.22 L•mol-1(结果精确到0.01);若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的A点
(3)某温度时,亚硝酸银AgNO2的 Ksp=9.0×10-4、Ag2SO4的Ksp=4.0×10-5,当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol•L-1)时,c(NO2-)=4.5×10-4 mol•L-1.
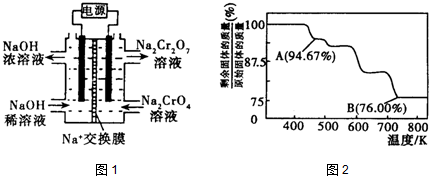
(4)如图2,在酸性条件下,电解水中CN-可转化为CO2和N2,请写出阳极的电极反应式2CN-+4H2O-10e-=N2↑+2CO2↑+8H+.
分析 (1)已知:反应Ⅰ:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-746kJ•mol-1
反应Ⅱ:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H=-1200kJ•mol-1
根据盖斯定律,$\frac{1}{2}$(Ⅱ-Ⅰ)得到CO(g)+NO2(g)?CO2(g)+NO(g),据此计算;
(2)①根据反应2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-746kJ•mol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大;
②用CO的浓度变化表示的平均反应速率v(CO)=$\frac{△c}{△t}$结合热化学方程式的意义回答计算;
③根据三行式结合化学平衡移动原理来回答;
(3)根据沉淀溶解平衡常数Ksp进行计算;
(4)在电解池的阳极上发生失电子的氧化反应,据此书写电极反应.
解答 解:(1)已知:反应Ⅰ:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-746kJ•mol-1
反应Ⅱ:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H=-1200kJ•mol-1
根据盖斯定律,$\frac{1}{2}$(Ⅱ-Ⅰ)得到CO(g)+NO2(g)?CO2(g)+NO(g),)△H=$\frac{1}{2}$(-1200kJ•mol-1+746kJ•mol-1)=-227 kJ•mol-1;
故答案为:CO(g)+NO2(g)?CO2(g)+NO(g)△H=-227 kJ•mol-1;
(2)①根据反应2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-746kJ•mol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大,即T1>T2,故答案为:>;
②在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,根据反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-746kJ•mol-1,消耗CO的物质的量是$\frac{373×2}{746}$=1moL,v(CO)=$\frac{△c}{△t}$=$\frac{\frac{1mol}{2L}}{10min}$=0.05 mol•L-1•min-1;故答案为:0.05 mol•L-1•min-1;
③某温度下,反应达到平衡状态D点时,NO的体积分数是25%,设CO的变化浓度是x,
2CO(g)+2NO(g)?N2(g)+2CO2(g)
初始浓度:2.5 2 0 0
变化浓度:x x 0.5x x
平衡浓度:2.5-x 2-x 0.5x x
NO的体积分数是25%,即$\frac{2-x}{2.5-x+2-x+0.5x+x}$×100%=25%,解得x=1,此时K=$\frac{{1}^{2}×0.5}{1.{5}^{2}×1}$=0.22 L•mol-1;若在D点对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加,重新达到的平衡状态可能是图中A点,
故答案为:0.22 L•mol-1;A;
(3)当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀,根据Ag2SO4的Ksp=4.0×10-5,此时银离子浓度=$\sqrt{\frac{4.0×1{0}^{-5}}{1.0×1{0}^{-5}}}$=2.0,c(NO2-)=
$\frac{9.0×1{0}^{-4}}{2.0}$=4.5×10-4 mol•L-1;故答案为:4.5×10-4 mol•L-1;
(4)在酸性条件下,电解水中CN-可转化为CO2和N2,阳极上发生失电子的氧化反应,其电极反应式为:2CN-+4H2O-10e-=N2↑+2CO2↑+8H+,故答案为:2CN-+4H2O-10e-=N2↑+2CO2↑+8H+.
点评 本题涉及盖斯定律的应用、化学平衡的有关计算,电极反应式的书写知识,注意知识的综合应用是关键,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | NaHS03溶液显酸性:HS03-═H++S032- | |
| B. | 苯酚钠溶液中通入少量C02: C6H50+CO2+H20→C6H50H+HCO3- | |
| C. | 强碱性溶液中次氯酸钠溶液与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2Fe042-+3Cl-+H20+4H+ | |
| D. | 向 Ca(Cl0)2 溶液中通入过量 S02:Ca2++2C10-+SO2═CaSO4↓+2Cl- |
| A. | NA个OH- | B. | 3NA个离子 | C. | 2NA原子 | D. | 10NA个电子 |
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
| A. | 20 g D2O所含的电子数为10 NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1 NA | |
| C. | 1 mo1 Na被氧化成Na2O2,失去电子数目为2 NA | |
| D. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为2 NA |
| A. | 乙醇难溶于水 | B. | 乙烯可使酸性KMnO4溶液褪色 | ||
| C. | 乙酸的酸性比碳酸弱 | D. | 苯不能萃取碘水中的碘单质 |
| A. | 在上述条件下,SO2可能100%的转化为SO3 | |
| B. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| C. | 达到平衡时,SO2与SO3的浓度保持不变 | |
| D. | 为了提高SO2的转化率,可以适当提高O2的浓度 |
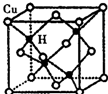 铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图所示,若CuH的密度为d g•cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为$\root{3}{\frac{260}{d{N}_{A}}}$cm(用含d和NA的式子表示).
铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图所示,若CuH的密度为d g•cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为$\root{3}{\frac{260}{d{N}_{A}}}$cm(用含d和NA的式子表示).