题目内容
17.关于下列各有机物的说法正确的是( )| A. | 乙醇难溶于水 | B. | 乙烯可使酸性KMnO4溶液褪色 | ||
| C. | 乙酸的酸性比碳酸弱 | D. | 苯不能萃取碘水中的碘单质 |
分析 A.乙醇易溶于水;
B.乙烯含有碳碳双键,可被氧化;
C.乙酸含有羧基,酸性比碳酸强;
D.碘易溶于有机溶剂.
解答 解:A.乙醇含有羟基,易与水形成氢键,易溶于水,故A错误;
B.乙烯含有碳碳双键,可被酸性高锰酸钾氧化,故B正确;
C.乙酸含有羧基,酸性比碳酸强,故C错误;
D.碘易溶于有机溶剂,可用苯萃取,故D错误.
故选B.
点评 本题综合考查有机物的性质,为高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
7.纯过氧化氢是淡蓝色的粘稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体.实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组的同学绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学校认为:
(1)写出过氧化氢的电子式 ;
;
(2)实验室中用过氧化氢制取氧气的化学方程式为2H2O2$\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑,当生成标准状况下2.24LO2时,转移电子为0.2mol;
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱.请写出H2O2在其水溶液中的电离方程式H2O2?HO2-+H+,HO2-?H++O22-;
(4)同学们用0.1000mol•L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,其反应原理为2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2.
①在该反应中,H2O2被氧化(填“氧化”或“还原”)
②滴定到达终点的现象是锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色;
③用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
则试样中过氧化氢的浓度为0.1800mol•L-1;
④若滴定前尖嘴中有气泡,滴定后消失,则滴定结果偏高(填“偏低”、“偏高”或“不变”);
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失.关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色.请设计一个简单的实验方案来判断甲乙两位同学的说法是否正确:在褪色后的溶液中,加入适量的NaOH溶液,若又出现红色,则甲同学的观点正确;若未出现红色,则乙同学的观点正确.
(1)写出过氧化氢的电子式
 ;
;(2)实验室中用过氧化氢制取氧气的化学方程式为2H2O2$\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑,当生成标准状况下2.24LO2时,转移电子为0.2mol;
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱.请写出H2O2在其水溶液中的电离方程式H2O2?HO2-+H+,HO2-?H++O22-;
(4)同学们用0.1000mol•L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,其反应原理为2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2.
①在该反应中,H2O2被氧化(填“氧化”或“还原”)
②滴定到达终点的现象是锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色;
③用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
 | 第一次 | 第二次 | 第三次 | 第四次 |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
④若滴定前尖嘴中有气泡,滴定后消失,则滴定结果偏高(填“偏低”、“偏高”或“不变”);
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失.关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色.请设计一个简单的实验方案来判断甲乙两位同学的说法是否正确:在褪色后的溶液中,加入适量的NaOH溶液,若又出现红色,则甲同学的观点正确;若未出现红色,则乙同学的观点正确.
5.下列实验方法或操作正确的是( )
| A. |  配制稀盐酸 | B. |  检验K+ | C. |  获取NaCl | D. |  收集NO |
12.下列过程需要吸收热量的是( )
| A. | 汽油燃烧 | B. | 铝热反应 | C. | 液氨汽化 | D. | 酸碱中和 |
9.碳酸镁晶须是一种新型吸波隐形材料中的增强剂.某工厂以MgCl2(含少量杂质FeCl2、FeCl3)为原料制备碳酸镁晶须(MgCO3•H2O)的工艺流程如下:
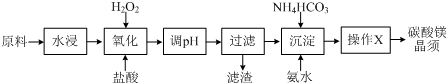
已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
注:Fe(OH)2沉淀呈絮状,不易从溶液中除去.
(1)写出“氧化”过程中发生的离子反应方程式并用单线桥标出电子转移的方向和数目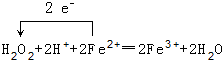 .
.
(2)pH调节的范围3.7~9.9之间,滤渣的主要成分Fe(OH)3(填化学式).
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法取最后一次洗涤液,加入硝酸酸化,再加入硝酸银溶液,没有白色沉淀生成,说明洗涤干净.
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00mL,测得Cl-的浓度为0.455mol•L-1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl-的浓度为0.460mol•L-1(溶液体积变化忽略不计).
②另取水浸后溶液100.00mL,向其中加入过量的1mol•L-1NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96g.
试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度(写出计算过程).

已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.9 | 11.1 |
(1)写出“氧化”过程中发生的离子反应方程式并用单线桥标出电子转移的方向和数目
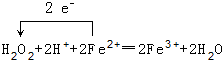 .
.(2)pH调节的范围3.7~9.9之间,滤渣的主要成分Fe(OH)3(填化学式).
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法取最后一次洗涤液,加入硝酸酸化,再加入硝酸银溶液,没有白色沉淀生成,说明洗涤干净.
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00mL,测得Cl-的浓度为0.455mol•L-1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl-的浓度为0.460mol•L-1(溶液体积变化忽略不计).
②另取水浸后溶液100.00mL,向其中加入过量的1mol•L-1NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96g.
试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度(写出计算过程).
7.下列说法不正确的是( )
| A. | 锡中加入一定量的铅制成焊锡,目的使被焊接的部分更牢固,更不易被氧化 | |
| B. | 聚乙烯制成塑料薄膜,用于食品、药品包装的材料 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 含重金属离子的电镀废液不能随意排放 |

 ),继而合成H的路线如下:
),继而合成H的路线如下:
 ,D中含有官能团的名称为羰基、醛基;
,D中含有官能团的名称为羰基、醛基; +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$ +H2O;
+H2O; 、
、 、
、 、
、 .
.