题目内容
3.NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 20 g D2O所含的电子数为10 NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1 NA | |
| C. | 1 mo1 Na被氧化成Na2O2,失去电子数目为2 NA | |
| D. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为2 NA |
分析 A、重水的摩尔质量为20g/mol,含10个电子;
B、溶液体积不明确;
C、钠反应后变为+1价;
D、当反应生成2molHCl时,断裂2mol化学键.
解答 解:A、重水的摩尔质量为20g/mol,含10个电子,故20g重水的物质的量为1mol,故含10mol电子即10NA个,故A正确;
B、溶液体积不明确,故溶液中氢氧根的个数无法计算,故B错误;
C、钠反应后变为+1价,故1mol钠失去1mol电子即NA个,故C错误;
D、当反应生成2molHCl时,断裂2mol化学键,故当生成标况下22.4LHCl即1molHCl时,断裂1mol化学键即NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
13.下列关于浓硫酸的说法正确的是( )
| A. | 在加热条件下能使不活泼金属铜溶解,表现出浓硫酸的强氧化性和酸性 | |
| B. | 可以用铁制或铝制容器贮运,表现出浓硫酸有稳定的化学性质 | |
| C. | 能使胆矾晶体由蓝色变为白色,表现出浓硫酸的脱水性 | |
| D. | 能使蔗糖炭化,表现出浓硫酸的吸水性 |
14.下列微粒中,最重的是( )
| A. | α粒子 | B. | 质子 | C. | 中子 | D. | ${\;}_{1}^{1}$ H |
11.下列属于氧化还原反应的是( )
| A. | NaOH+HCl═NaCl+H2O | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | ||
| C. | SO3+H2O═H2SO4 | D. | NH4HCO3 $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ |
15.信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾.某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
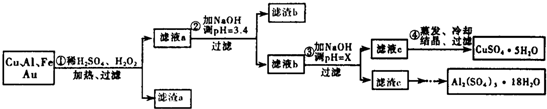
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是Cu+H2O2+2H+═Cu2++2H2O.
(3)滤渣a的主要成分是Au.
(4)步骤③中X的取值范围是5.2≤X<5.4.
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点.共消耗14.00mL
Na2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2 2${S_2}O_3^{2-}$+I2═2I-+${S_4}O_6^{2-}$
①样品中硫酸铜晶体的质量分数为87.5%.
②该组乙同学提出通过直接测定样品中$SO_4^{2-}$的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是样品中含有Na2SO4等杂质.
(6)请你设计一个由滤渣c得到Al2(SO4)3•18H2O的实验方案将滤渣c加入稀硫酸溶解,然后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体.

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH3) | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是Cu+H2O2+2H+═Cu2++2H2O.
(3)滤渣a的主要成分是Au.
(4)步骤③中X的取值范围是5.2≤X<5.4.
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点.共消耗14.00mL
Na2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2 2${S_2}O_3^{2-}$+I2═2I-+${S_4}O_6^{2-}$
①样品中硫酸铜晶体的质量分数为87.5%.
②该组乙同学提出通过直接测定样品中$SO_4^{2-}$的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是样品中含有Na2SO4等杂质.
(6)请你设计一个由滤渣c得到Al2(SO4)3•18H2O的实验方案将滤渣c加入稀硫酸溶解,然后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体.
12.下列过程需要吸收热量的是( )
| A. | 汽油燃烧 | B. | 铝热反应 | C. | 液氨汽化 | D. | 酸碱中和 |
13.煤化工中常需研究不同温度下的平衡常数、投料比及产率等问题,提高一氧化碳制取氢气的产率是其重要研究之一.
(1)已知:
C(石墨)+$\frac{1}{2}$O2(g)=CO(g)△H1=-111kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H2=-242kJ/mol
C(石墨)+O2(g)=CO2(g)△H3=-394kJ/mol
请写出一氧化碳那与水作用转化为氢气和二氧化碳反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol;
(2)能判断该反应达到化学平衡状态的依据是( )(填序号);
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(3)已知一氧化碳与水作用转化为氢气和二氧化碳的化学平衡常数随温度的变化如下表:
在800℃时,2L的密闭容器中加入4molCO(g)和6molH2O(g),10min后达到平衡时CO2的平衡浓度为1.2mol/L,用H2浓度变化来表示的平均反应速率为0.12mol/(L•min),CO的转化率是60%;
(4)为使该反应的速率增大且平衡向正反应方向移动,可采取的措施是A.
A.增大CO浓度 B.升高温度
C.将生成物分离出去 D.使用高效催化剂.
(1)已知:
C(石墨)+$\frac{1}{2}$O2(g)=CO(g)△H1=-111kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H2=-242kJ/mol
C(石墨)+O2(g)=CO2(g)△H3=-394kJ/mol
请写出一氧化碳那与水作用转化为氢气和二氧化碳反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol;
(2)能判断该反应达到化学平衡状态的依据是( )(填序号);
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(3)已知一氧化碳与水作用转化为氢气和二氧化碳的化学平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(4)为使该反应的速率增大且平衡向正反应方向移动,可采取的措施是A.
A.增大CO浓度 B.升高温度
C.将生成物分离出去 D.使用高效催化剂.

