题目内容
13.铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.(1)还原沉淀法是处理含$C{r_2}O_7^{2-}$和$CrO_4^{2-}$工业废水的一种常用方法,其工艺流程为:$CrO_4^{2-}$$\underset{\stackrel{{H}^{+}}{→}}{I转化}$$C{r_2}O_7^{2-}$$\underset{\stackrel{F{e}^{2+}}{→}}{II还原}$Cr3+$\frac{O{H}^{-}}{III沉淀}$Cr(OH)3↓
其中第Ⅰ步存在平衡:
2$CrO_4^{2-}$(黄色)+2H+?$C{r_2}O_7^{2-}$(橙色)+H2O
①若平衡体系的pH=0,该溶液显橙色.
②根据2$CrO_4^{2-}$+2H+?$C{r_2}O_7^{2-}$+H2O,设计如图1装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7.Na2Cr2O7中铬元素的化合价为+6,图中右侧电极连接电源的正极,其电极反应式为4OH--4e-=O2↑+2H2O.
③第Ⅱ步反应的离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O.
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火.若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3.完成该反应的化学方程式:
□CrO3+□C2H5OH+□H2SO4═□Cr2(SO4)3+□CH3COOH+□9H2O
(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图2所示.B点时剩余固体的成分是Cr2O3(填化学式).
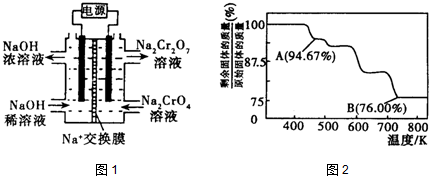
分析 (1)①根据氢离子对2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O平衡移动的影响判断;
②根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O;
③亚铁离子与Cr2O72-发生氧化还原反应;
(2)根据化合价升降总数相等以及原子守恒来解答;
(3)根据质量守恒定律,在变化过程中,Cr的质量没有变,求出氧原子和铬原子的个数比即可.
解答 解:(1)①若平衡体系的pH=0,溶液酸性较强,平衡2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O正向移动,溶液呈橙色,故答案为:橙;
②由化合价代数和为0可知Na2Cr2O7中铬元素的化合价为+6价,根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O,
故答案为:+6;正;4OH--4e-=O2↑+2H2O;
③亚铁离子与Cr2O72-发生氧化还原反应,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O,
故答案为:4;3;6;2;3;9H2O;
(3)设固体质量为100g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为16,两者的个数比为$\frac{52}{52}$:$\frac{24}{16}$=2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3,故答案为:Cr2O3.
点评 本题综合考查较为综合,涉及化学平衡原理、氧化还原反应、离子方程式的书写等内容,侧重于反应原理的应用的考查,分析时要根据题给信息,结合相关原理进行解答,题目难度中等.

| A. | 烧杯 | B. | 试管 | C. | 胶头滴管 | D. | 100mL容量瓶 |
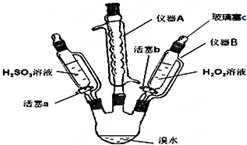 为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去).请回答下列问题:
为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去).请回答下列问题:(1)仪器A的名称球形冷凝管,其作用是冷凝回流溴,以免溴挥发.
(2)用仪器B滴加液体并不需要打开玻璃塞c,原因是滴液漏斗和三颈瓶相通,气压相等.
(3)实验记录如下(请补全空白):
| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| Ⅰ | 打开活塞a,逐滴加入H2SO3溶液至过量 | 橙黄色褪去 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 | 刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 | H2O2的氧化性大于Br2 |
步骤Ⅰ中反应的离子方程式H2SO3+Br2+H2O=4H++SO42-+2Br-,
步骤Ⅱ中主要反应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
| A. | R的气态氢化物比W的气态氢化物更稳定 | |
| B. | Z的氧化物能与盐酸反应,不能与NaOH溶液反应 | |
| C. | 原子半径按X、R、W、Z、Y的顺序依次增大 | |
| D. | X、Y、Z的最高化合价数值均等于其主族序数 |
| A. |  配制稀盐酸 | B. |  检验K+ | C. |  获取NaCl | D. |  收集NO |

 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.