题目内容
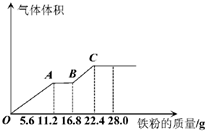 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析错误的是( )| A、AB段的反应为:Fe+2Fe3+=3Fe2+ |
| B、第二份溶液中最终溶质为FeSO4 |
| C、混合酸中NO3-物质的量为0.4mol |
| D、混合酸中H2SO4浓度为5mol?L-1 |
考点:化学方程式的有关计算
专题:计算题
分析:由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,
A.铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应;
B.铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸;
C.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
D.根据铁和硫酸的反应中铁的质量来确定所需硫酸的量,进而确定硫酸的浓度.
A.铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应;
B.铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸;
C.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
D.根据铁和硫酸的反应中铁的质量来确定所需硫酸的量,进而确定硫酸的浓度.
解答:
解:A.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故A正确;
B.硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故B正确;
C.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,故原混合液中n(NO3-)=2n(Fe)=2×
=0.4mol,故C正确;
D.第二份反应消耗22.4g铁,物质的量为
=0.4mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所原混合酸中H2SO4物质的量为0.4 mol×2=0.8mol,原混合溶液中硫酸浓度为
=4mol/L,故D错误.
故选D.
B.硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故B正确;
C.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,故原混合液中n(NO3-)=2n(Fe)=2×
| 11.2g |
| 56g/mol |
D.第二份反应消耗22.4g铁,物质的量为
| 22.4g |
| 56g/mol |
| 0.8mol |
| 0.2L |
故选D.
点评:本题以图象为载体考查金属和酸反应的有关计算,难度中等,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用.

练习册系列答案
相关题目
化学与生活密切相关,以下有关说法不正确的是( )
| A、维生素C具有还原性,在人体内起抗氧化作用 |
| B、先通入氯气,再加入硫酸亚铁处理水,能达到消毒杀菌和除去悬浮杂质的目的 |
| C、地沟油经过一系列加工后,可以转化为生物柴油用作发动机燃料,变废为宝 |
| D、鸡蛋清中加人CuSO4溶液会产生盐析现象,析出的蛋白质可再溶于水 |
下列说法不正确的是( )
| A、复分解反应一定不是氧化还原反应 |
| B、置换反应一定是氧化还原反应 |
| C、有单质参加的化合反应一定是氧化还原反应 |
| D、没有单质生成的分解反应一定不是氧化还原反应 |
下列叙述中正确的是( )
| A、硝酸的摩尔质量63g |
| B、1mol CO的体积约为22.4L |
| C、2g氢气所含原子数目为1mol |
| D、铁的摩尔质量在数值上等于铁原子的相对原子质量 |
我国科学家在世界上首次合成了三种新核素,其中一种新核素是185Hf(铪).关于185Hf的下列说法中,正确的是( )
| A、是一种新元素 |
| B、原子核内有185个质子 |
| C、原子核内有185个中子 |
| D、是183Hf的一种新的同位素 |