题目内容
9.在光照条件下,分子式为C5H12的烷烃与氯气发生取代反应,生成物中含有两个氯原子且氯原子位于相邻碳原子上的结构最多有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 分子为C5H12为戊烷,戊烷的同分异构体有3种,正戊烷、异戊烷和新戊烷,然后根据题中限制条件“生成物中含有两个氯原子且位于相邻碳原子上”写出满足条件的有机物的结构简式.
解答 解:分子为C5H12为戊烷,戊烷的同分异构体有3种,正戊烷、异戊烷和新戊烷,分别为:
CH3-CH2-CH2-CH2-CH3、 、
、 ;
;
CH3-CH2-CH2-CH2-CH3两个氯原子且氯原子位于相邻碳原子上的结构最多有2种,1,2号碳或2,3号碳; 两个氯原子且氯原子位于相邻碳原子上的结构最多有3种,1,2号碳或2,3号碳或3,4号碳;
两个氯原子且氯原子位于相邻碳原子上的结构最多有3种,1,2号碳或2,3号碳或3,4号碳; 无两个氯原子且氯原子位于相邻碳原子上的结构;
无两个氯原子且氯原子位于相邻碳原子上的结构;
故选C.
点评 本题考查了同分异构体的书写,题目难度中等,明确同分异构体的书写原则及题中限制条件的含义为解答关键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
19.将7g某铜、银合金与足量的a mol/L HNO3充分反应,完全溶解后放出的气体与标准状况下的氧气0.56L混合,通入水中恰好完全吸收,则此合金中铜的质量是( )
| A. | 1.6 g | B. | 2.4 g | C. | 3.2 g | D. | 4.8 g |
17.I:工业制硫酸时,利用接触氧化反应将SO 2转化为SO3是一个关键步骤.
(1)某温度下,2SO2(g)+O2(g)═2SO3(g)△H=-197kJ/mol.开始时在10L的密闭容器中加入8.0mol SO2(g)和20.0 mol O2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K=0.56(mol/L)-1(保留两位有效数字),若升高温度时,K将减小(填“增大、减小或不变”).
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是AC(填字母).
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件
(以V2O5作催化剂)温度450℃;压强1×105Pa,选择此压强的理由再增压转化率增大不明显,加大成本
(4)能判断该反应达到平衡状态的依据是ACF
A.容器的压强不变 B.混合气体的密度不变 C.混合气体中SO3的浓度不变
D.c(SO2)=c(SO3) E.v正(SO2)=v 正(SO3) F.v正(SO3)=2v逆(O2)
(1)某温度下,2SO2(g)+O2(g)═2SO3(g)△H=-197kJ/mol.开始时在10L的密闭容器中加入8.0mol SO2(g)和20.0 mol O2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K=0.56(mol/L)-1(保留两位有效数字),若升高温度时,K将减小(填“增大、减小或不变”).
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是AC(填字母).
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件
(以V2O5作催化剂)温度450℃;压强1×105Pa,选择此压强的理由再增压转化率增大不明显,加大成本
| 1×l05 Pa | 5×l05 Pa | 10×l05 Pa | 50×l05 Pa | 100×l05 Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
A.容器的压强不变 B.混合气体的密度不变 C.混合气体中SO3的浓度不变
D.c(SO2)=c(SO3) E.v正(SO2)=v 正(SO3) F.v正(SO3)=2v逆(O2)
4.如表是元素周期表的前四周期:
回答下列问题:
(1)G元素与E元素形成的化合物的化学式可能是Na2O、Na2O2,I与J的原子序数相差为18.
(2)上述10种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(用化合物的化学式表示,下同),酸性最强的是HClO4,E、F、G三种元素形成的简单离子半径由大到小的顺序是O2->F->Na+(用离子符号回答).
| I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | |||||
| 四 | J |
(1)G元素与E元素形成的化合物的化学式可能是Na2O、Na2O2,I与J的原子序数相差为18.
(2)上述10种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(用化合物的化学式表示,下同),酸性最强的是HClO4,E、F、G三种元素形成的简单离子半径由大到小的顺序是O2->F->Na+(用离子符号回答).
14.有机物X的分子式为C7H14O2.其水解可得到CH3OH,则X的结构有(不考虑立体异构)( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
1.NA为阿伏加德罗常数的值,下列说法错误的是( )
| A. | 标准状况下,11.2L N2和O2混合气体中所含分子数为0.5NA | |
| B. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4NA | |
| C. | 常温常压下,20g ND3中所含质子数为10NA | |
| D. | 向含0.2mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目为NA |
16.许多化学反应都伴随着明显而美丽的颜色变化,给学习和生活带来无穷乐趣,下列颜色变化中不属于化学变化的是( )
| A. | 新制氯水使有色布条褪色 | B. | 过氧化钠使某些燃料褪色 | ||
| C. | 二氧化硫使溴水褪色 | D. | 活性炭使红墨水褪色 |
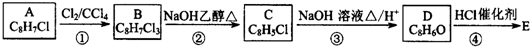
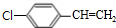 ,B中含有的官能团是氯原子.
,B中含有的官能团是氯原子.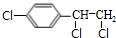 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$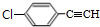 +2NaCl+2H2O,其反应类型为消去反应.
+2NaCl+2H2O,其反应类型为消去反应.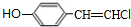 ;
;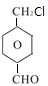 、
、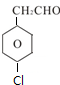 .
.