题目内容
17.I:工业制硫酸时,利用接触氧化反应将SO 2转化为SO3是一个关键步骤.(1)某温度下,2SO2(g)+O2(g)═2SO3(g)△H=-197kJ/mol.开始时在10L的密闭容器中加入8.0mol SO2(g)和20.0 mol O2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K=0.56(mol/L)-1(保留两位有效数字),若升高温度时,K将减小(填“增大、减小或不变”).
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是AC(填字母).
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件
(以V2O5作催化剂)温度450℃;压强1×105Pa,选择此压强的理由再增压转化率增大不明显,加大成本
| 1×l05 Pa | 5×l05 Pa | 10×l05 Pa | 50×l05 Pa | 100×l05 Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
A.容器的压强不变 B.混合气体的密度不变 C.混合气体中SO3的浓度不变
D.c(SO2)=c(SO3) E.v正(SO2)=v 正(SO3) F.v正(SO3)=2v逆(O2)
分析 (1)根据热化学方程式及放出的热量可计算出平衡时各物质的物质的量,进而求得平衡浓度,根据平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积求得平衡常数,根据温度对平衡的影响判断K的变化;
(2)A.可逆反应中增加一种反应物的浓度可以提高另一种反应物的转化率;
B.减小一种反应物的浓度可以降低另一种反应物的转化率;
C.增大压强,平衡向体积减小的方向移动;
D.减小压强,平衡向体积增大的方向移动;
E.加入催化剂,对平衡没有影响;
(3)根据表中数据,在温度一定时,压强对转化率的影响,在压强一定时,温度对转化率的影响,据此选择合适的条件;
(4)根据正逆反应速率相等、各组份的组成不变以及某些外部特征可判断反应是否处于平衡状态.
解答 解:(1)根据反应2SO2(g)+O 2(g)?2SO3(g)△H=-197kJ/mol,当放出394kJ的热量时,生成SO3的物质的量为394/197×2mol=4mol,所以平衡时SO2的浓度为 $\frac{8.0mol-4mol}{10L}$=0.4mol/L,SO3的浓度为0.4mol/L,O2的浓度为 $\frac{20mol-2mol}{10L}$=1.8mol/L,所以K=$\frac{0.42}{0.42×1.8}$=0.56,该反应为放热反应,所以升高温度平衡向逆反应方程移动,平衡常数减小,
故答为:0.56;减小;
(2)A.可逆反应中增加一种反应物的浓度可以提高另一种反应物的转化率,所以通入氧气,二氧化硫的转化率提高,故A正确;
B.减小一种反应物的浓度可以降低另一种反应物的转化率,所以移出氧气,二氧化硫的转化下降高,故B错误;
C.该反应为体积减小的反应,增大压强,平衡向体积减小的方向移动,二氧化硫的转化率提高,故C正确;
D.减小压强,平衡向体积增大的方向移动,二氧化硫的转化率减小,故D错误;
E.加入催化剂,对平衡没有影响;
故选AC;
(3)根据表中数据,在温度一定时,压强越大,二氧化硫的转化率越高,但增加的幅度不大,在压强一定时,温度越高转化率越小,考滤生成成本等因素,所以选择的条件是450℃,1×105Pa,
故答案为:450℃;1×105Pa;
(4)A.该反应为体积减小的反应,所以容器的压强不变,反应达到平衡状态,故A正确;
B.该反应前后气体质量守恒,体积不变,所以混合气体的密度不变,不能判断反应是否处于平衡状态,故B错误;
C.混合气体中SO3的浓度不变,则反应处于平衡状态,故C正确;
D.C(SO2)=C(SO3),不能说明正逆反应速率是否相等,故D错误;
E.v 正(SO2)=v 正(SO3),都是指正反应速率,不能确定与逆反应的关系,故E错误;
F.v 正(SO3)=2v 逆(O2),说明正逆反应速率相等,所以反应处于平衡状态,故F正确,
故选:ACF.
点评 本题考查了平衡状态的判断、化学平衡的影响因素及平衡常数的有关计算等知识点,难度中等,答题时注意分析表中数据,总结规律.

 阅读快车系列答案
阅读快车系列答案①溶液中有Fe2+、Cu2+、不溶物为Cu
②溶液中有Fe2+、Cu2+、不溶物为Fe
③溶液中只有Cu2+、不溶物为Fe
④溶液中只有Fe2+、不溶物为Fe,Cu.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
| A. |  除去NO中的NO2 | B. |  干燥Cl2 | C. |  稀释浓硫酸 | D. |  制备少量O2 |
①取代反应 ②加成反应 ③消去反应 ④聚合反应.
| A. | 以上反应均可发生 | B. | 只有①不能发生 | ||
| C. | 只有③不能发生 | D. | 只有④不能发生 |
| A. | CO2和氢气合成甲烷,实现“碳循环” | |
| B. | 提倡步行、骑自行车、乘公交车等“低碳”出行方式 | |
| C. | 采用纳米TiO2光触媒技术将装修材料中释放的HCHO转化为无害物质 | |
| D. | 将造纸废水通过高压水井压到地下或溶洞中,减少对地表水的污染 |
| A. | Cl元素的相对原子质量为37 | |
| B. | $\frac{1}{20}$mol的1H37Cl分子所含中子数约为6.02×1023 | |
| C. | 7.4 g的37Cl2气体的体积为2.24L | |
| D. | 37Cl2气体的摩尔质量为74g |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
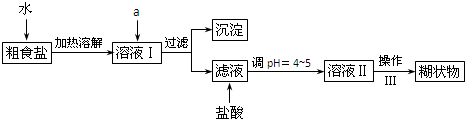
提供的试剂:饱和Na2CO3溶液,饱和K2CO3溶液,NaOH溶液,BaCl2溶液,Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为BaCl2、NaOH、Na2CO3
BaCl2、NaOH、Na2CO3(只填化学式).
②加盐酸的目的是(用离子方程式表示)H++OH-=H2O2H++CO32-=CO2↑+H2O.
(2)某化学小组拟采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性.
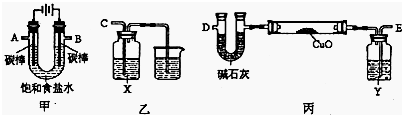
①乙装置中X试剂可以是NaBr的CCl4溶液,现象是溶液分层,下层是橙红色溶液.
②为完成上述实验,正确的连接顺序为A连E,B连CC(填接口字母).
③丙装置中Y试剂的作用是干燥H2,丙中碱石灰的作用是吸收CuO、H2反应生成的水.
④测定Cu的相对原子质量.
将ω g CuO置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量.
| 方案 质量 | 方案一 | 方案二 |
| U型管+固体 | 硬质玻璃管+固体 | |
| 反应前质量/g | a | c |
| 完全反应后质量/g | b | d |
偏低(填“偏低”、“偏高”).按较佳方案计算,得到Cu的相对原子质量是$\frac{16(d+w-c)}{c-d}$.
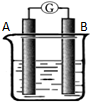 某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.
某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.| 序号 | A | B | 烧杯中的液体 |
| 1 | Mg | Al | 稀H2SO4 |
| 2 | Pt | Pt | NaOH溶液 |
| 3 | Pt | Pt | 熔融的Na2CO3 |
| 4 | Pb | PbO2 | 稀H2SO4 |
(2)第2组实验中,向A、B极附近分别通入H2和O2,则负极的电极反应式为2H2+4OH--4e-=4H2O.正极区溶液的PH值变大(填变大、减小或不变).
(3)第3组实验中,向A极附近通入CO,向B极附近通入CO2及O2的混合气体,则正极的电极反应式为O2+4e-+2CO2=2CO32-.
(4)第4组实验中,总反应方程式为Pb+PbO2+2H2SO4═2PbSO4+2H2O.负极反应式为Pb-2e-+SO42-=PbSO4,则正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.该电池工作时,如果正极材料质量增加96克,理论上在外电路通过得电子数目为3NA或1.806×1024.