题目内容
15.某元素R原子的核外电子数等于核内中子数,该元素的单质2.8g与氧气充分反应,生成6.0g的化合物RO2.请回答:(1)元素R的原子序数是14.
(2)元素R的原子共有3个电子层,能量最低的电子层中共有2个电子.
分析 (1)该元素的单质2.8g与氧气充分反应,生成6.0g的化合物RO2,需要氧气的质量为3.2g,设R的摩尔质量为Mg/mol,则$\frac{2.8g}{Mg/mol}$=$\frac{1}{2}$,所以M=28,根据原子中核外电子数、质子数、质量数、中子数的关系得,R的原子序数=质子数=$\frac{质量数}{2}$=14,该元素为Si元素;
(2)Si原子核外有3电子层,从K到M层电子数分别是2、8、4,K层能量最低.
解答 解:(1)某元素R原子的核外电子数等于核内中子数,该元素的单质2.8g与氧气充分反应,生成6.0g的化合物RO2,需要氧气的质量为3.2g,设R的摩尔质量为Mg/mol,则$\frac{2.8g}{Mg/mol}$=$\frac{1}{2}$,所以M=28,根据原子中核外电子数、质子数、质量数、中子数的关系得,R的原子序数=质子数=$\frac{质量数}{2}$=14,该元素为Si元素,
故答案为:14;
(2)Si是14号元素,其原子核外有K、L、M三个电子层,从内到外其能量逐渐升高,能量最低的K层电子数是2,
故答案为:3;2.
点评 本题考查了原子结构和元素性质,涉及原子核外电子排布、质子数和质量数及中子数的关系、元素周期律等知识点,侧重学生对基础知识的考查,题目难度不大.

练习册系列答案
相关题目
8.下列实验装置,试剂选用或操作正确的是( )
| A. |  除去NO中的NO2 | B. |  干燥Cl2 | C. |  稀释浓硫酸 | D. |  制备少量O2 |
9.在光照条件下,分子式为C5H12的烷烃与氯气发生取代反应,生成物中含有两个氯原子且氯原子位于相邻碳原子上的结构最多有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
3.食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
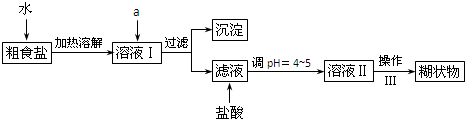
提供的试剂:饱和Na2CO3溶液,饱和K2CO3溶液,NaOH溶液,BaCl2溶液,Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为BaCl2、NaOH、Na2CO3
BaCl2、NaOH、Na2CO3(只填化学式).
②加盐酸的目的是(用离子方程式表示)H++OH-=H2O2H++CO32-=CO2↑+H2O.
(2)某化学小组拟采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性.
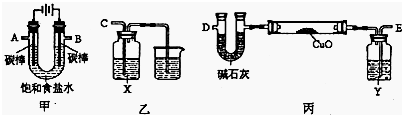
①乙装置中X试剂可以是NaBr的CCl4溶液,现象是溶液分层,下层是橙红色溶液.
②为完成上述实验,正确的连接顺序为A连E,B连CC(填接口字母).
③丙装置中Y试剂的作用是干燥H2,丙中碱石灰的作用是吸收CuO、H2反应生成的水.
④测定Cu的相对原子质量.
将ω g CuO置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量.
请回答:你认为方案二较佳,另一个方案得到的Cu的相对原子质量会偏低
偏低(填“偏低”、“偏高”).按较佳方案计算,得到Cu的相对原子质量是$\frac{16(d+w-c)}{c-d}$.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液,饱和K2CO3溶液,NaOH溶液,BaCl2溶液,Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为BaCl2、NaOH、Na2CO3
BaCl2、NaOH、Na2CO3(只填化学式).
②加盐酸的目的是(用离子方程式表示)H++OH-=H2O2H++CO32-=CO2↑+H2O.
(2)某化学小组拟采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性.

①乙装置中X试剂可以是NaBr的CCl4溶液,现象是溶液分层,下层是橙红色溶液.
②为完成上述实验,正确的连接顺序为A连E,B连CC(填接口字母).
③丙装置中Y试剂的作用是干燥H2,丙中碱石灰的作用是吸收CuO、H2反应生成的水.
④测定Cu的相对原子质量.
将ω g CuO置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量.
| 方案 质量 | 方案一 | 方案二 |
| U型管+固体 | 硬质玻璃管+固体 | |
| 反应前质量/g | a | c |
| 完全反应后质量/g | b | d |
偏低(填“偏低”、“偏高”).按较佳方案计算,得到Cu的相对原子质量是$\frac{16(d+w-c)}{c-d}$.
20.关于氢键,下列说法正确的是( )
| A. | 氢键是一种化学键 | |
| B. | 冰中存在氢键、液态氟化氢中不存在氢键 | |
| C. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| D. | 氨气极易溶于水,重要的原因之一是由于氨分子与水分子之间能形成氢键 |
7.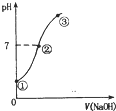 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HC1O的电离平衡 | |
| B. | ②到③的过程中水的电离程度一定减少 | |
| C. | ②点处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ②点所示溶液中:c( Na+)=c(C1-)+c(ClO -) |
4.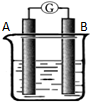 某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.
某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.
(1)第1组实验中的负极是Mg.正极的电极反应式为2H++2e-=H2↑.若将烧杯中的液体换为NaOH溶液,则负极为Al.该电极的电极反应式为2Al+8OH--6e-=2AlO2-+4H2O.
(2)第2组实验中,向A、B极附近分别通入H2和O2,则负极的电极反应式为2H2+4OH--4e-=4H2O.正极区溶液的PH值变大(填变大、减小或不变).
(3)第3组实验中,向A极附近通入CO,向B极附近通入CO2及O2的混合气体,则正极的电极反应式为O2+4e-+2CO2=2CO32-.
(4)第4组实验中,总反应方程式为Pb+PbO2+2H2SO4═2PbSO4+2H2O.负极反应式为Pb-2e-+SO42-=PbSO4,则正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.该电池工作时,如果正极材料质量增加96克,理论上在外电路通过得电子数目为3NA或1.806×1024.
 某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.
某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.| 序号 | A | B | 烧杯中的液体 |
| 1 | Mg | Al | 稀H2SO4 |
| 2 | Pt | Pt | NaOH溶液 |
| 3 | Pt | Pt | 熔融的Na2CO3 |
| 4 | Pb | PbO2 | 稀H2SO4 |
(2)第2组实验中,向A、B极附近分别通入H2和O2,则负极的电极反应式为2H2+4OH--4e-=4H2O.正极区溶液的PH值变大(填变大、减小或不变).
(3)第3组实验中,向A极附近通入CO,向B极附近通入CO2及O2的混合气体,则正极的电极反应式为O2+4e-+2CO2=2CO32-.
(4)第4组实验中,总反应方程式为Pb+PbO2+2H2SO4═2PbSO4+2H2O.负极反应式为Pb-2e-+SO42-=PbSO4,则正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.该电池工作时,如果正极材料质量增加96克,理论上在外电路通过得电子数目为3NA或1.806×1024.
5.下列离子方程式中,正确的是( )
| A. | 铜粉加入到Fe2(SO4)3溶液中:Cu+Fe3+═Cu2++Fe | |
| B. | 钠块投入到CuSO4溶液中:2Na+Cu2+═2Na++Cu↓ | |
| C. | Cl2通入到NaOH溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 用NaOH溶液吸收少量CO2:OH-+CO2═HCO${\;}_{3}^{-}$ |