题目内容
7.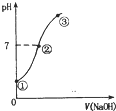 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HC1O的电离平衡 | |
| B. | ②到③的过程中水的电离程度一定减少 | |
| C. | ②点处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ②点所示溶液中:c( Na+)=c(C1-)+c(ClO -) |
分析 A.①点所示溶液中只存在HCl0的电离平衡、氯气的溶解平衡和水的电离平衡;
B.当氯气与氢氧化钠溶液恰好反应生成氯化钠、次氯酸钠和水时,水的电离程度达到最大,而②点pH=7,说明②到③的过程中水的电离程度先最大后减少;
C.当恰好反应时溶液显示碱性,而②点为中性;
D.②点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-)判断.
解答 解:A.①为饱和氯水,饱和氯水中存在次氯酸的电离平衡、水的电离平衡和氯气的溶解平衡,故A错误;
B.①到②的过程中,氯水中氢离子浓度逐渐减小,水的电离程度逐渐增大,当氯气和氢氧化钠溶液恰好完全反应时,水的电离程度达到最大,此时溶质为氯化钠和次氯酸钠,溶液呈碱性,而②点为中性,说明②到③的过程中水的电离程度先增大,之后氢氧化钠过量后水的电离程度开始减小,故B错误;
C.当氯气与氢氧化钠溶液恰好反应时生成氯化钠、次氯酸钠和水,次氯酸根离子部分水解,溶液呈碱性,而②的pH=7,为中性溶液,说明氯水稍过量,二者没有恰好反应,故C错误;
D.②点溶液中溶质为NaCl、NaClO、HClO,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得:c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),故D正确;
故选D.
点评 本题综合考查较为综合,涉及氯气的性质、微粒浓度大小比较、弱电解质的电离等知识,题目难度中等,侧重于学生的分析能力的考查,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.NA为阿伏加德罗常数的值,下列说法错误的是( )
| A. | 标准状况下,11.2L N2和O2混合气体中所含分子数为0.5NA | |
| B. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4NA | |
| C. | 常温常压下,20g ND3中所含质子数为10NA | |
| D. | 向含0.2mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目为NA |
2.下列分子中所有原子都满足最外层为8电子结构的是( )
| A. | BF3 | B. | CO2 | C. | NH3 | D. | PCl5 |
12.下列各组溶液中,只用试管和胶头滴管,不用其他任何试剂就可以鉴别的是( )
| A. | 稀氨水和Al2(SO4)3 | B. | 稀盐酸和Na2CO3 | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
16.许多化学反应都伴随着明显而美丽的颜色变化,给学习和生活带来无穷乐趣,下列颜色变化中不属于化学变化的是( )
| A. | 新制氯水使有色布条褪色 | B. | 过氧化钠使某些燃料褪色 | ||
| C. | 二氧化硫使溴水褪色 | D. | 活性炭使红墨水褪色 |
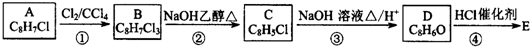
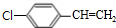 ,B中含有的官能团是氯原子.
,B中含有的官能团是氯原子.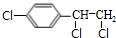 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$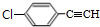 +2NaCl+2H2O,其反应类型为消去反应.
+2NaCl+2H2O,其反应类型为消去反应.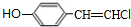 ;
;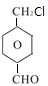 、
、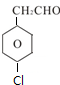 .
.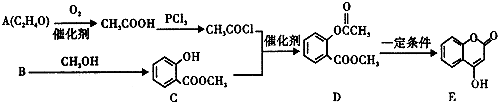
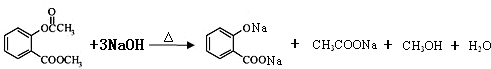 .
.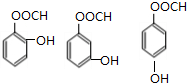 .
.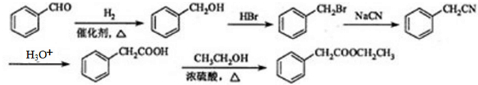 .
.