题目内容
19.在空气中燃烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为Co3O4.分析 烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),n(CO2)=$\frac{1.344L}{22.4L/mol}$=0.06mol,由化学式可知n(Co)=0.06mol×$\frac{1}{2}$=0.03mol,则氧化物中n(O)=$\frac{2.41g-0.03mol×59g/mol}{16g/mol}$=0.04mol,以此来解答.
解答 解:煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),n(CO2)=$\frac{1.344L}{22.4L/mol}$=0.06mol,由化学式可知n(Co)=0.06mol×$\frac{1}{2}$=0.03mol,则氧化物中n(O)=$\frac{2.41g-0.03mol×59g/mol}{16g/mol}$=0.04mol,则n(Co):n(O)=0.03mol:0.04mol=3:4,所以钴氧化物的化学式为Co3O4,
故答案为:Co3O4.
点评 本题考查化学方程式计算,为高频考点,明确各个物理量关系及发生的反应是解本题关键,注意守恒方法的灵活运用,题目难度中等.

练习册系列答案
相关题目
12.化学与社会可持续发展密切相关.下列做法不合理的是( )
| A. | CO2和氢气合成甲烷,实现“碳循环” | |
| B. | 提倡步行、骑自行车、乘公交车等“低碳”出行方式 | |
| C. | 采用纳米TiO2光触媒技术将装修材料中释放的HCHO转化为无害物质 | |
| D. | 将造纸废水通过高压水井压到地下或溶洞中,减少对地表水的污染 |
7. 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HC1O的电离平衡 | |
| B. | ②到③的过程中水的电离程度一定减少 | |
| C. | ②点处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ②点所示溶液中:c( Na+)=c(C1-)+c(ClO -) |
14. 某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).则该混合溶液中NaOH与Na2CO3物质的量之比为( )
某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).则该混合溶液中NaOH与Na2CO3物质的量之比为( )
 某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).则该混合溶液中NaOH与Na2CO3物质的量之比为( )
某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).则该混合溶液中NaOH与Na2CO3物质的量之比为( )| A. | 1:1 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
4. 某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.
某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.
(1)第1组实验中的负极是Mg.正极的电极反应式为2H++2e-=H2↑.若将烧杯中的液体换为NaOH溶液,则负极为Al.该电极的电极反应式为2Al+8OH--6e-=2AlO2-+4H2O.
(2)第2组实验中,向A、B极附近分别通入H2和O2,则负极的电极反应式为2H2+4OH--4e-=4H2O.正极区溶液的PH值变大(填变大、减小或不变).
(3)第3组实验中,向A极附近通入CO,向B极附近通入CO2及O2的混合气体,则正极的电极反应式为O2+4e-+2CO2=2CO32-.
(4)第4组实验中,总反应方程式为Pb+PbO2+2H2SO4═2PbSO4+2H2O.负极反应式为Pb-2e-+SO42-=PbSO4,则正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.该电池工作时,如果正极材料质量增加96克,理论上在外电路通过得电子数目为3NA或1.806×1024.
 某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.
某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.| 序号 | A | B | 烧杯中的液体 |
| 1 | Mg | Al | 稀H2SO4 |
| 2 | Pt | Pt | NaOH溶液 |
| 3 | Pt | Pt | 熔融的Na2CO3 |
| 4 | Pb | PbO2 | 稀H2SO4 |
(2)第2组实验中,向A、B极附近分别通入H2和O2,则负极的电极反应式为2H2+4OH--4e-=4H2O.正极区溶液的PH值变大(填变大、减小或不变).
(3)第3组实验中,向A极附近通入CO,向B极附近通入CO2及O2的混合气体,则正极的电极反应式为O2+4e-+2CO2=2CO32-.
(4)第4组实验中,总反应方程式为Pb+PbO2+2H2SO4═2PbSO4+2H2O.负极反应式为Pb-2e-+SO42-=PbSO4,则正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.该电池工作时,如果正极材料质量增加96克,理论上在外电路通过得电子数目为3NA或1.806×1024.
11.下列离子方程式正确的是( )
| A. | 铝溶解在NaOH溶液中:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| B. | 氨水滴入AlCl3溶液中:Al3++3OH-═Al(OH)3↓ | |
| C. | MgO溶于稀盐酸中:O2-+2H+═H2O | |
| D. | Al(OH)3溶于稀硫酸中:OH-+H+═H2O |
8.某校化学兴趣小组对以下种品牌牙膏中摩擦剂成分进行调查,结果如下表
试回答下列问题
(1)两面针儿童牙膏中摩擦剂成分与HCl溶液反应的离子方程式是Al(OH)3+3H+═Al3++3H2O
(2)中华透明牙膏摩擦剂与NaOH溶液反应的化学方程式是SiO2+2NaOH=Na2SiO3+H2O
(3)利用如图所示装罟(图中夹持仪器略去)进行实验充分反应后,分离出C装置中沉淀,经洗涤干燥称重,即可测定珍珠防臭牙膏样品中碳酸钙的质量分数.
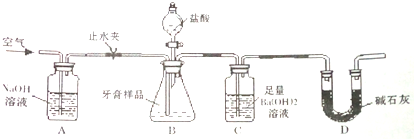
依据实验过程回答下列问题:
①试剂瓶D中碱石灰的作用是防止空气中的水蒸气、二氧化碳进入装置C中被氢氧化钡溶液吸收造成测定误差
②C中反应生成BaC03的离子方程式是CO2+Ba(OH)2═BaCO3↓+H2O.
③下列各项措施中,不能提高测定准确度的是cd(填标号)
a.经A装置通人空气排净装置内的CO2气体,并关闭止水夹
b.自分液漏斗滴加足量盐酸,滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
e.待B中无气泡冒出后,打开止水夹,经A装置继续通空气将装置中残余CO2排出
④准确称取珍珠防臭牙膏样品8.00g进行实验,测得BaCO3质量为3.94g,则该样品中碳酸钙的质量分数为25%
⑤有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样以确定碳酸钙的质量分数,实验证明按此方法测定的结果明显偏高,原因是B中的水蒸气、氯化氢气体等进入装置C中.
| 牙膏品牌 | 两面针儿童牙膏 | 中华透明牙膏 | 珍珠防臭牙膏 |
| 摩擦剂 | 氢氧化铝 | 二氧化硅 | 碳酸钙 |
(1)两面针儿童牙膏中摩擦剂成分与HCl溶液反应的离子方程式是Al(OH)3+3H+═Al3++3H2O
(2)中华透明牙膏摩擦剂与NaOH溶液反应的化学方程式是SiO2+2NaOH=Na2SiO3+H2O
(3)利用如图所示装罟(图中夹持仪器略去)进行实验充分反应后,分离出C装置中沉淀,经洗涤干燥称重,即可测定珍珠防臭牙膏样品中碳酸钙的质量分数.

依据实验过程回答下列问题:
①试剂瓶D中碱石灰的作用是防止空气中的水蒸气、二氧化碳进入装置C中被氢氧化钡溶液吸收造成测定误差
②C中反应生成BaC03的离子方程式是CO2+Ba(OH)2═BaCO3↓+H2O.
③下列各项措施中,不能提高测定准确度的是cd(填标号)
a.经A装置通人空气排净装置内的CO2气体,并关闭止水夹
b.自分液漏斗滴加足量盐酸,滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
e.待B中无气泡冒出后,打开止水夹,经A装置继续通空气将装置中残余CO2排出
④准确称取珍珠防臭牙膏样品8.00g进行实验,测得BaCO3质量为3.94g,则该样品中碳酸钙的质量分数为25%
⑤有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样以确定碳酸钙的质量分数,实验证明按此方法测定的结果明显偏高,原因是B中的水蒸气、氯化氢气体等进入装置C中.
9.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | C2H4通入溴水中 | 溶液褪色 | C2H4跟Br2发生加成反应 |
| B | 向溶液X中滴入NaHCO3溶液 | 产生无色气体 | X中的溶质一定是酸 |
| C | Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加 0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生, 硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |