题目内容
17.化合物E常用于制备抗凝血药,可以通过如图所示路线合成.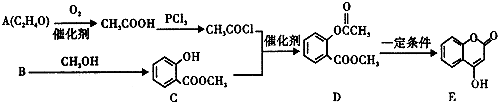
(1)B中含氧官能团的名称是羧基、羟基,检验A中官能团的常用试为银氨溶液或新制氢氧化铜悬浊液.
(2)C→D的反应类型为取代反应,1mol E最多可与4 molH2发生加成反应.
(3)写出D与足量NaOH溶液完全反应的化学方程式
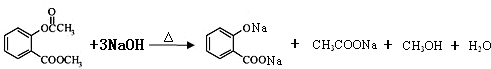 .
.(4)B有多种同分异构体,写出同时满足下列条件的所有同分异构体的结构简式
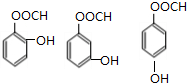 .
.?①能发生银镜反应
?②能与FeCl3溶液发生显色反应
?③1mol该同分异构体与NaOH溶液反应时,最多可消耗3mol NaOH.
(5)苯乙酸乙酯是一种常见的合成香料,请设计合理的方案以苯甲醛和乙醇为原料合成苯乙酸乙酯(无机试剂任选):
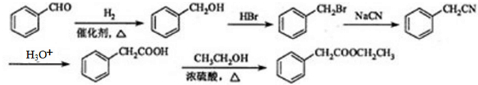 .
.
分析 (1)B与甲醇发生酯化反应得到C,可推知B为 ,A发生氧化反应生成乙酸,则A为CH3CHO;
,A发生氧化反应生成乙酸,则A为CH3CHO;
(2)对比C、D结构可知,C中酚羟基中H原子被-COCH3取代生成D;E中苯环与C=C双键与氢气发生加成反应;
(3)D中存在酯基,在碱液中可以发生水解反应,水解生成的羧基、酚羟基与NaOH发生中和反应,反应生成 、CH3COONa、CH3OH;
、CH3COONa、CH3OH;
(4)B为 ,B的同分异构体符合:能够发生银镜反应,说明含有醛基;能与FeCl3溶液发生显色反应,含酚羟基,1mol该同分异构体与NaOH溶液反应时,最多可消耗3mol NaOH,则含有甲酸与酚形成的酯基,有邻、间、对3种;
,B的同分异构体符合:能够发生银镜反应,说明含有醛基;能与FeCl3溶液发生显色反应,含酚羟基,1mol该同分异构体与NaOH溶液反应时,最多可消耗3mol NaOH,则含有甲酸与酚形成的酯基,有邻、间、对3种;
(5)苯甲醛与氢气发生加成反应生成苯甲醇,再发生取代反应生成 ,与NaCN发生取代反应得到
,与NaCN发生取代反应得到 ,再水解得到苯乙酸,苯乙酸与乙醇发生酯化反应得到苯乙酸乙酯.
,再水解得到苯乙酸,苯乙酸与乙醇发生酯化反应得到苯乙酸乙酯.
解答 解:(1)B与甲醇发生酯化反应得到C,可推知B为 ,含有官能团为羧基、羟基,A发生氧化反应生成乙酸,则A为CH3CHO,含有官能团为醛基,用银氨溶液或新制氢氧化铜悬浊液检验醛基,
,含有官能团为羧基、羟基,A发生氧化反应生成乙酸,则A为CH3CHO,含有官能团为醛基,用银氨溶液或新制氢氧化铜悬浊液检验醛基,
故答案为:羧基、羟基;银氨溶液或新制氢氧化铜悬浊液;
(2)对比C、D结构可知,C中酚羟基中H原子被-COCH3取代生成D,属于取代反应;E中苯环与C=C双键与氢气发生加成反应,故1mol E最多可与4mol H2反应,
故答案为:取代反应;4;
(3)D中存在酯基,在碱液中可以发生水解反应,水解生成的羧基、酚羟基与NaOH发生中和反应,反应生成 、CH3COONa、CH3OH,反应方程式为:
、CH3COONa、CH3OH,反应方程式为: ,
,
故答案为: ;
;
(4)B为 ,B的同分异构体符合:能够发生银镜反应,说明含有醛基;能与FeCl3溶液发生显色反应,含酚羟基,1mol该同分异构体与NaOH溶液反应时,最多可消耗3mol NaOH,则含有甲酸与酚形成的酯基,有邻、间、对3种,符合条件的同分异构体结构简式为:
,B的同分异构体符合:能够发生银镜反应,说明含有醛基;能与FeCl3溶液发生显色反应,含酚羟基,1mol该同分异构体与NaOH溶液反应时,最多可消耗3mol NaOH,则含有甲酸与酚形成的酯基,有邻、间、对3种,符合条件的同分异构体结构简式为: ,
,
故答案为: ;
;
(5)苯甲醛与氢气发生加成反应生成苯甲醇,再发生取代反应生成 ,与NaCN发生取代反应得到
,与NaCN发生取代反应得到 ,再水解得到苯乙酸,苯乙酸与乙醇发生酯化反应得到苯乙酸乙酯,合成路线流程图为:
,再水解得到苯乙酸,苯乙酸与乙醇发生酯化反应得到苯乙酸乙酯,合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用有机物的结构进行分析解答,熟练掌握官能团的性质与转化,侧重考查学生分析推理能力.

 习题精选系列答案
习题精选系列答案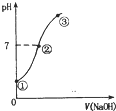 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HC1O的电离平衡 | |
| B. | ②到③的过程中水的电离程度一定减少 | |
| C. | ②点处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ②点所示溶液中:c( Na+)=c(C1-)+c(ClO -) |
| 牙膏品牌 | 两面针儿童牙膏 | 中华透明牙膏 | 珍珠防臭牙膏 |
| 摩擦剂 | 氢氧化铝 | 二氧化硅 | 碳酸钙 |
(1)两面针儿童牙膏中摩擦剂成分与HCl溶液反应的离子方程式是Al(OH)3+3H+═Al3++3H2O
(2)中华透明牙膏摩擦剂与NaOH溶液反应的化学方程式是SiO2+2NaOH=Na2SiO3+H2O
(3)利用如图所示装罟(图中夹持仪器略去)进行实验充分反应后,分离出C装置中沉淀,经洗涤干燥称重,即可测定珍珠防臭牙膏样品中碳酸钙的质量分数.
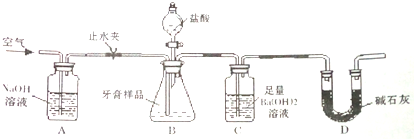
依据实验过程回答下列问题:
①试剂瓶D中碱石灰的作用是防止空气中的水蒸气、二氧化碳进入装置C中被氢氧化钡溶液吸收造成测定误差
②C中反应生成BaC03的离子方程式是CO2+Ba(OH)2═BaCO3↓+H2O.
③下列各项措施中,不能提高测定准确度的是cd(填标号)
a.经A装置通人空气排净装置内的CO2气体,并关闭止水夹
b.自分液漏斗滴加足量盐酸,滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
e.待B中无气泡冒出后,打开止水夹,经A装置继续通空气将装置中残余CO2排出
④准确称取珍珠防臭牙膏样品8.00g进行实验,测得BaCO3质量为3.94g,则该样品中碳酸钙的质量分数为25%
⑤有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样以确定碳酸钙的质量分数,实验证明按此方法测定的结果明显偏高,原因是B中的水蒸气、氯化氢气体等进入装置C中.
| A. | 铜粉加入到Fe2(SO4)3溶液中:Cu+Fe3+═Cu2++Fe | |
| B. | 钠块投入到CuSO4溶液中:2Na+Cu2+═2Na++Cu↓ | |
| C. | Cl2通入到NaOH溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 用NaOH溶液吸收少量CO2:OH-+CO2═HCO${\;}_{3}^{-}$ |
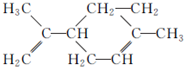 ,有关柠檬烯的说法正确的是( )
,有关柠檬烯的说法正确的是( )| A. | 柠檬烯分子为非极性分子 | |
| B. | 柠檬烯分子中所有碳原子处于同一个平面上 | |
| C. | 柠檬烯能与酸性高锰酸钾溶液发生取代反应 | |
| D. | 柠檬烯的分子式为C10H16,能使溴的四氯化碳溶液褪色 |
 一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.叙述正确的是( )
一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.叙述正确的是( )| A. | 温度T℃时,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{c}_{{T}^{2}}}$ | |
| B. | 温度T℃时,混合气体的密度不变即达到平衡状态 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b改变的条件是温度,则该正反应放热 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | C2H4通入溴水中 | 溶液褪色 | C2H4跟Br2发生加成反应 |
| B | 向溶液X中滴入NaHCO3溶液 | 产生无色气体 | X中的溶质一定是酸 |
| C | Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加 0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生, 硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | HCl | B. | NaCl | C. | N2 | D. | NO |