题目内容
下列各组离子在指定条件下,一定能大量共存的是( )
| A、pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- |
| B、能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、NO3- |
| C、能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl- |
| D、水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、Cl-、NO3- |
考点:离子共存问题
专题:
分析:A.无色溶液中不存在有色离子,铜离子为有色离子;
B.能溶解Al(OH)3固体的溶液为酸性或强碱性溶液,碳酸氢根离子既能够与氢离子反应也能够与氢氧根离子反应;
C.能使碘化钾淀粉试纸变蓝的溶液具有氧化性,亚铁离子具有还原性,能够被该溶液氧化;
D.水电离出的c(H+)=10-12mol/L的溶液为酸性或碱性溶液,Ba2+、Na+、Cl-、NO3-离子之间不发生反应,且都不与氢离子和氢氧根离子反应.
B.能溶解Al(OH)3固体的溶液为酸性或强碱性溶液,碳酸氢根离子既能够与氢离子反应也能够与氢氧根离子反应;
C.能使碘化钾淀粉试纸变蓝的溶液具有氧化性,亚铁离子具有还原性,能够被该溶液氧化;
D.水电离出的c(H+)=10-12mol/L的溶液为酸性或碱性溶液,Ba2+、Na+、Cl-、NO3-离子之间不发生反应,且都不与氢离子和氢氧根离子反应.
解答:
解:A.Cu2+为有色离子,不满足溶液无色的条件,故A错误;
B.能溶解Al(OH)3固体的溶液中存在大量氢离子或氢氧根离子,HCO3-能够与氢离子和氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.能使碘化钾淀粉试纸变蓝的溶液具有强氧化性,能够氧化Fe2+,在溶液中不能大量共存,故C错误;
D.水电离出的c(H+)=10-12mol/L的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,Ba2+、Na+、Cl-、NO3-离子之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
B.能溶解Al(OH)3固体的溶液中存在大量氢离子或氢氧根离子,HCO3-能够与氢离子和氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.能使碘化钾淀粉试纸变蓝的溶液具有强氧化性,能够氧化Fe2+,在溶液中不能大量共存,故C错误;
D.水电离出的c(H+)=10-12mol/L的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,Ba2+、Na+、Cl-、NO3-离子之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评:本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
准确量取25.00mL KMnO4溶液于锥形瓶中并用某无色未知浓度的还原性A溶液进行滴定,所选仪器和指示剂均正确的是( )
| A、50 mL酸式滴定管;甲基橙 |
| B、50 mL碱式滴定管;酚酞 |
| C、50 mL量筒;石蕊 |
| D、50 mL酸式滴定管;不用指示剂 |
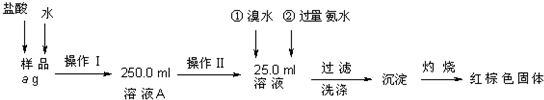
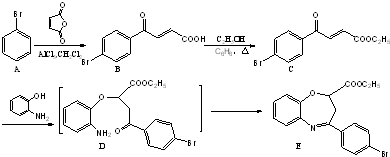
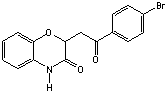 和一种常见的有机物F,F的结构简式为
和一种常见的有机物F,F的结构简式为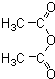
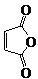 俗名“马莱酐”,它是马莱酸(顺丁烯二酸:)的酸酐.
俗名“马莱酐”,它是马莱酸(顺丁烯二酸:)的酸酐.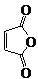 为原料制备化合物
为原料制备化合物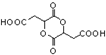 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:

 ),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:
),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例: