题目内容
烧碱在保存过程会部分变质(杂质主要为Na2CO3).
Ⅰ.定性检验
取少量烧碱样品于试管,加蒸馏水使其完全溶解.向所得溶液滴加几滴试剂 ,预期现象与结论是 .
Ⅱ.定量测定
准确称取5.0g样品配制成250mL溶液,各取配制好的烧碱溶液20.00mL于三个锥形瓶中,分别加入过量的BaCl2溶液(使Na2CO3完全转变成BaCO3沉淀),并向锥形瓶中各加入1~2滴指示剂(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10),用浓度为0.2000mol?L-1的盐酸标准液进行滴定.相关数据记录如下:
试回答:
(1)如何确定BaCl2溶液是否滴加过量? .
(2)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用 做指示剂,理由是 ;判断到达滴定终点的实验现象是 .
(3)滴定时的正确操作是 .依据表中数据,计算出烧碱样品中含NaOH的质量分数为 %.(小数点后保留两位数字)
(4)下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数.
Ⅰ.定性检验
取少量烧碱样品于试管,加蒸馏水使其完全溶解.向所得溶液滴加几滴试剂
Ⅱ.定量测定
准确称取5.0g样品配制成250mL溶液,各取配制好的烧碱溶液20.00mL于三个锥形瓶中,分别加入过量的BaCl2溶液(使Na2CO3完全转变成BaCO3沉淀),并向锥形瓶中各加入1~2滴指示剂(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10),用浓度为0.2000mol?L-1的盐酸标准液进行滴定.相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.50 | 31.50 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
(1)如何确定BaCl2溶液是否滴加过量?
(2)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用
(3)滴定时的正确操作是
(4)下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:Ⅰ、烧碱在保存过程会部分变质(杂质主要为Na2CO3),定性检验,依据碳酸根离子结合钡离子生成白色沉淀判断烧碱是否变质,取少量烧碱样品于试管,加蒸馏水使其完全溶解.向所得溶液滴加试剂氯化钡溶液,
若出现白色沉淀,则说明已变质,反之则未变质;
Ⅱ、(1)取少量烧碱样品于试管,加蒸馏水使其完全溶解.向所得溶液滴加试剂氯化钡溶液,取上层清液滴加氯化钡溶液,看是否有沉淀生成分析判断氯化钡溶液过量与否;
(2)测定放置已久的NaOH纯度,杂质主要为Na2CO3,配制溶液后加入过量氯化钡溶液分离出沉淀后的溶液中含有氢氧化钠,用盐酸滴定测定,酸滴定碱指示反应终点的指示剂可以是酚酞;滴入最后一滴溶液颜色变化后半分钟不变化证明反应达到终点;
(3)依据中和滴定实验过程和操作规范要求分析回答滴定时的正确操作;依据图表数据计算三次实验的平均值,结合酸碱反应定量关系计算氢氧化钠物质的量,得到样品中所含氢氧化钠的质量分数;
(4)依据误差分析的方法分析判断,c(待测)=
.
若出现白色沉淀,则说明已变质,反之则未变质;
Ⅱ、(1)取少量烧碱样品于试管,加蒸馏水使其完全溶解.向所得溶液滴加试剂氯化钡溶液,取上层清液滴加氯化钡溶液,看是否有沉淀生成分析判断氯化钡溶液过量与否;
(2)测定放置已久的NaOH纯度,杂质主要为Na2CO3,配制溶液后加入过量氯化钡溶液分离出沉淀后的溶液中含有氢氧化钠,用盐酸滴定测定,酸滴定碱指示反应终点的指示剂可以是酚酞;滴入最后一滴溶液颜色变化后半分钟不变化证明反应达到终点;
(3)依据中和滴定实验过程和操作规范要求分析回答滴定时的正确操作;依据图表数据计算三次实验的平均值,结合酸碱反应定量关系计算氢氧化钠物质的量,得到样品中所含氢氧化钠的质量分数;
(4)依据误差分析的方法分析判断,c(待测)=
| c(标准)V(标准) |
| V(待测) |
解答:
解:Ⅰ、烧碱在保存过程会部分变质(杂质主要为Na2CO3),定性检验,依据碳酸根离子结合钡离子生成白色沉淀判断烧碱是否变质,取少量烧碱样品于试管,加蒸馏水使其完全溶解.向所得溶液滴加试剂氯化钡溶液,若出现白色沉淀,则说明已变质,反之则未变质;
故答案为:BaCl2溶液;若出现白色沉淀,则说明已变质,反之则未变质;
Ⅱ、(1)取少量烧碱样品于试管,加蒸馏水使其完全溶解.向所得溶液滴加试剂氯化钡溶液,取上层清液滴加氯化钡溶液,看是否有沉淀生成分析判断氯化钡溶液过量与否操作步骤为:静置,向上层清液中继续滴加1滴BaCl2溶液,若未产生白色沉淀,说明已滴加过量,反之则未过量;
故答案为:静置,向上层清液中继续滴加1滴BaCl2溶液,若未产生白色沉淀,说明已滴加过量,反之则未过量;
(2)烧碱在保存过程会部分变质(杂质主要为Na2CO3),准确称取5.000g样品配制成250mL溶液,各取配制好的烧碱溶液20.00mL于三个大试管中,分别滴入过量的BaCl2溶液,用离心机分离后将滤液转移到三个锥形瓶中,向锥形瓶中各加入1~2滴指示剂,依据现有酸碱指示剂及变色的pH范围为:①甲基橙3.1~4.4 ②酚酞8.2~10),酸滴定碱溶液选择指示剂可以是酚酞,酚酞的变色在碱性范围内,此时只有NaOH与HCl反应,BaCO3不与HCl反应;用浓度为0.2000mol?L-1的盐酸标准液进行滴定;滴入最后一滴溶溶液的颜色刚好红色变为浅红色,且半分钟内颜色不变化即为滴定终点,
故答案为:酚酞;酚酞的变色在碱性范围内,此时只有NaOH与HCl反应,BaCO3不与HCl反应,滴入最后一滴时,溶液的颜色刚好红色变为浅红色,且半分钟内颜色不变化即为滴定终点;
(3)滴定时的正确操作是:左手控制活塞,右手不断摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化;
图表数据计算三次实验的平均值,盐酸体积的平均值=
=31.04ml,结合酸碱反应定量关系计算氢氧化钠物质的量=
=0.3104mol/L,250ml溶液中含氢氧化钠物质的量=0.3104mol/L×0.250L=0.0776mol,得到样品中所含氢氧化钠的质量分数=
×100%=62.08%,
故答案为:左手控制活塞,右手不断摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化;62.08;
(4)A.锥形瓶用蒸馏水洗后未用待测液润洗,对滴定结果无影响,故A不符合;
B.酸式滴定管用蒸馏水洗后未用标准液润洗,标准液浓度减小,消耗的溶液体积增大,测定结果偏高,故B符合;
C.在滴定前有气泡,滴定后气泡消失,标准液的体积增大,测定结果偏高,故C符合;
D.滴定前平视读数,滴定结束俯视读数读取标准液的体积减小,测定结果偏低,故D不符合,
故答案为:BC.
故答案为:BaCl2溶液;若出现白色沉淀,则说明已变质,反之则未变质;
Ⅱ、(1)取少量烧碱样品于试管,加蒸馏水使其完全溶解.向所得溶液滴加试剂氯化钡溶液,取上层清液滴加氯化钡溶液,看是否有沉淀生成分析判断氯化钡溶液过量与否操作步骤为:静置,向上层清液中继续滴加1滴BaCl2溶液,若未产生白色沉淀,说明已滴加过量,反之则未过量;
故答案为:静置,向上层清液中继续滴加1滴BaCl2溶液,若未产生白色沉淀,说明已滴加过量,反之则未过量;
(2)烧碱在保存过程会部分变质(杂质主要为Na2CO3),准确称取5.000g样品配制成250mL溶液,各取配制好的烧碱溶液20.00mL于三个大试管中,分别滴入过量的BaCl2溶液,用离心机分离后将滤液转移到三个锥形瓶中,向锥形瓶中各加入1~2滴指示剂,依据现有酸碱指示剂及变色的pH范围为:①甲基橙3.1~4.4 ②酚酞8.2~10),酸滴定碱溶液选择指示剂可以是酚酞,酚酞的变色在碱性范围内,此时只有NaOH与HCl反应,BaCO3不与HCl反应;用浓度为0.2000mol?L-1的盐酸标准液进行滴定;滴入最后一滴溶溶液的颜色刚好红色变为浅红色,且半分钟内颜色不变化即为滴定终点,
故答案为:酚酞;酚酞的变色在碱性范围内,此时只有NaOH与HCl反应,BaCO3不与HCl反应,滴入最后一滴时,溶液的颜色刚好红色变为浅红色,且半分钟内颜色不变化即为滴定终点;
(3)滴定时的正确操作是:左手控制活塞,右手不断摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化;
图表数据计算三次实验的平均值,盐酸体积的平均值=
| 31.50-0.50+32.04-1.00+32.18-1.10 |
| 3 |
| 31.04ml×0.200mol/L |
| 20.00ml |
| 0.0776mol×40g/mol |
| 5.000g |
故答案为:左手控制活塞,右手不断摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化;62.08;
(4)A.锥形瓶用蒸馏水洗后未用待测液润洗,对滴定结果无影响,故A不符合;
B.酸式滴定管用蒸馏水洗后未用标准液润洗,标准液浓度减小,消耗的溶液体积增大,测定结果偏高,故B符合;
C.在滴定前有气泡,滴定后气泡消失,标准液的体积增大,测定结果偏高,故C符合;
D.滴定前平视读数,滴定结束俯视读数读取标准液的体积减小,测定结果偏低,故D不符合,
故答案为:BC.
点评:本题考查了中和滴定,滴定实验的过程分析和计算应用,注意实验基本操作的理解应用,掌握基础和实验基本操作是解题关键,题目难度中等.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
下列各组离子在指定条件下,一定能大量共存的是( )
| A、pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- |
| B、能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、NO3- |
| C、能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl- |
| D、水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、Cl-、NO3- |
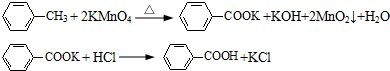
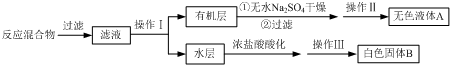

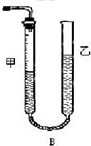 为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案.请回答每个方案中提出的问题.
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案.请回答每个方案中提出的问题.


