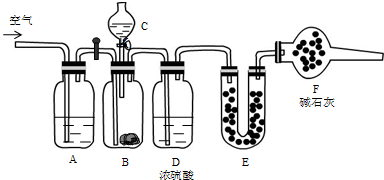
题目内容
100mL0.5mol/L的H2SO4溶液中加入1mol NaCl固体,此时溶液中含有H+、Cl-等.在100mL 1mol/L的HCl溶液中加入0.5mol Na2SO4,溶液中的离子与前面所述相同.将两种溶液加热,第一种溶液中会有HCl蒸发出来,那第二种溶液会吗?
考点:溶解度、饱和溶液的概念,氯、溴、碘及其化合物的综合应用
专题:
分析:盐酸与硫酸均属于强酸,由于硫酸属于高沸点酸,盐酸属于挥发性酸,故硫酸溶液中加入NaCl固体会生成HCl,据此解答即可.
解答:
解:盐酸与硫酸均属于强酸,由于硫酸属于高沸点酸,盐酸属于挥发性酸,故硫酸溶液中加入NaCl固体会生成HCl,化学反应方程式为:H2SO4+2NaCl=Na2SO4+2HCl↑,由于两种溶液中的离子浓度均相同,即第一种溶液与第二种溶液成分完全一样,第一种逸出HCl,第二种也能逸出HCl,故答案为:第二种溶液会逸出HCl.
点评:本题主要考查的是硫酸与盐酸的性质,抓住硫酸为难挥发性酸.盐酸为挥发性酸解答即可.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
已知Mg(OH)2和Al(OH)3是工业上常用的阻燃剂,Mg(OH)2的分解温度范围为340~490℃,氢氧化铝的分解温度范围为190~230℃,它们的热化学方程式分别为:
Mg(OH)2(s)=MgO(s)+H2O(g)△H1=+81.5kJ?mol-1
Al(OH)3(s)=
Al2O3(s)+
H2O(g)△H2=+87.7kJ?mol-1
下列说法不正确的是( )
Mg(OH)2(s)=MgO(s)+H2O(g)△H1=+81.5kJ?mol-1
Al(OH)3(s)=
| 1 |
| 2 |
| 3 |
| 2 |
下列说法不正确的是( )
| A、Mg(OH)2和Al(OH)3高温下不分解,所以可做工业阻燃剂 |
| B、等质量Mg(OH)2和Al(OH)3相比,Mg(OH)2阻燃效果较好 |
| C、Mg(OH)2比Al(OH)3热稳定性高 |
| D、Mg(OH)2和Al(OH)3作为工业阻燃剂与它们分解吸热及生成物具有耐高温性有关 |
下列各组离子在指定条件下,一定能大量共存的是( )
| A、pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- |
| B、能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、NO3- |
| C、能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl- |
| D、水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、Cl-、NO3- |
常温下,向VmL浓度为cmol/L的CH3COOH溶液中逐滴加入2VmL相同物质的量浓度的NaOH溶液,下列有关叙述正确的是( )
| A、原CH3COOH溶液中c(H+)与NaOH溶液中c(OH-)相等 |
| B、此过程溶液中水的电离程度先增大后减小,溶液的pH增大 |
| C、加至VmL时,溶液呈中性 |
| D、加至2VmL时,溶液中c(CH3COO-)+c(CH3COOH)=c(OH-)-c(H+) |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1mol过氧化钠与水反应转移电子数为NA |
| B、0.1mol氯化铁水解制成胶体,所得胶体粒子数为0.1NA |
| C、标准状况下,22.4L水中含有水分子数为NA |
| D、1L 0.1mol每升乙酸溶液中氢离子数为0.1NA |
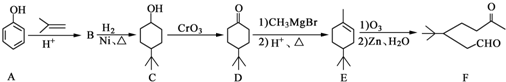
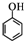 )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物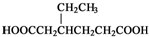 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用). 化工试剂草酸钠常用于制革、烟火、整理织物等.纯Na2C2O4为白色晶体,溶于水,不溶于乙醇,有还原性.实验室可用标准KMnO4溶液测定市售草酸钠中Na2C2O4的质量分数(假设杂质不与KMnO4反应).
化工试剂草酸钠常用于制革、烟火、整理织物等.纯Na2C2O4为白色晶体,溶于水,不溶于乙醇,有还原性.实验室可用标准KMnO4溶液测定市售草酸钠中Na2C2O4的质量分数(假设杂质不与KMnO4反应).