题目内容
有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去).请回答下列问题:

(1)B的结构简式是 ;E中含有的官能团名称是 .
(2)由c和E合成F的化学方程式是 .
(3)同时满足下列条件的苯的同分异构体的结构简式是 .
①含有3个双键;②核磁共振氢谱只显示1个吸收峰;③不存在甲基
(4)乙烯在实验室可由 (填有机物名称)通过 (填反应类型)制备,制乙烯时还产生少量SO2、CO2及水蒸气,用以下试剂检验这四种气体,混合气体通过试剂的顺序是 .(填序号).
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(5)下列说法正确的是 (填序号).
a.A属于饱和烃 b.D与乙醛的分子式相同
c.E不能与盐酸反应 d.F可以发生酯化反应
(6)以乙烯为原料可合成乙二酸二乙酯( ),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:
),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:
CH4
CH3Cl
CH3OH


(1)B的结构简式是
(2)由c和E合成F的化学方程式是
(3)同时满足下列条件的苯的同分异构体的结构简式是
①含有3个双键;②核磁共振氢谱只显示1个吸收峰;③不存在甲基
(4)乙烯在实验室可由
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(5)下列说法正确的是
a.A属于饱和烃 b.D与乙醛的分子式相同
c.E不能与盐酸反应 d.F可以发生酯化反应
(6)以乙烯为原料可合成乙二酸二乙酯(
 ),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:
),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:CH4
| Cl2 |
| 光照 |
| NaOH/H2O |
| △ |

考点:有机物的合成
专题:有机物的化学性质及推断
分析:在镍作催化剂条件下,苯和氢气发生加成反应生成A为环己烷,环己烷被氧气氧化生成B,在催化剂条件下,B和甲醇发生酯化反应生成C,根据C的结构结合B的分子式知,B是1,6-己二酸;在银作催化剂条件下,乙烯被氧气氧化生成环氧乙烷,环氧乙烷和氨气反应生成E,C和E反应生成F,据此答题.
解答:
解:在镍作催化剂条件下,苯和氢气发生加成反应生成环己烷,环己烷被氧气氧化生成B,在催化剂条件下,B和甲醇发生酯化反应生成C,根据C的结构结合B的分子式知,B是1,6-己二酸;
在银作催化剂条件下,乙烯被氧气氧化生成环氧乙烷,环氧乙烷和氨气发生加成反应生成E,C和E发生取代反应生成F,
(1)B是1,6-己二酸,其结构简式为:HOOC(CH2)4COOH,根据E的结构简式知,E中含有羟基和氨基,
故答案为:HOOC(CH2)4COOH;羟基和氨基;
(2)C和E发生取代反应生成F,反应方程式为:CH3OOC(CH2)4COOCH3+2HOCH2CH2NH2
HOCH2CH2NHOC(CH2)4CONHCH2CH2OH+2CH3OH,
故答案为:(CH2)4COOCH3+2HOCH2CH2NH2
HOCH2CH2NHOC(CH2)4CONHCH2CH2OH+2CH3OH;
(3)具备①含有3个双键、②核磁共振氢谱只显示1个吸收峰则该有机物中只含一种类型的氢原子、③不存在甲基的苯的同分异构体的结构简式为: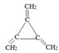 ,
,
故答案为: ;
;
(4)乙烯在实验室可由乙醇通过消去反应制取,制乙烯时还产生少量SO2、CO2及水蒸气,要检验这四种气体,可以先将混合气体通过无水CuSO4 检验水,再通过品红溶液,检验SO2,再通过饱和Na2SO3溶液,除去SO2,再通过石灰水检验CO2和通过酸性KMnO4溶液检验乙烯,所以加入试剂的顺序是 ④⑤①③②或④⑤①②③,
故答案为:乙醇;消去反应;④⑤①③②或④⑤①②③;
(5)a.环己烷中只存在共价单键,所以属于饱和烃,故正确;
b.环氧乙烷与乙醛的分子式都是C2H4O,所以分子式相同,故正确;
c.E中含有氨基,所以能与盐酸反应,故错误;
d.F中含有羟基,所以可以发生酯化反应,故正确;
故选abd;
(6)以乙烯为原料可合成乙二酸二乙酯,要先制得乙醇和乙二酸,乙二酸可由乙烯通过加成、水解、氧化制得,乙醇可由乙烯与水加成制得,所以合成路线为 ,
,
故答案为: .
.
在银作催化剂条件下,乙烯被氧气氧化生成环氧乙烷,环氧乙烷和氨气发生加成反应生成E,C和E发生取代反应生成F,
(1)B是1,6-己二酸,其结构简式为:HOOC(CH2)4COOH,根据E的结构简式知,E中含有羟基和氨基,
故答案为:HOOC(CH2)4COOH;羟基和氨基;
(2)C和E发生取代反应生成F,反应方程式为:CH3OOC(CH2)4COOCH3+2HOCH2CH2NH2
| 一定条件 |
故答案为:(CH2)4COOCH3+2HOCH2CH2NH2
| 一定条件 |
(3)具备①含有3个双键、②核磁共振氢谱只显示1个吸收峰则该有机物中只含一种类型的氢原子、③不存在甲基的苯的同分异构体的结构简式为:
 ,
,故答案为:
 ;
;(4)乙烯在实验室可由乙醇通过消去反应制取,制乙烯时还产生少量SO2、CO2及水蒸气,要检验这四种气体,可以先将混合气体通过无水CuSO4 检验水,再通过品红溶液,检验SO2,再通过饱和Na2SO3溶液,除去SO2,再通过石灰水检验CO2和通过酸性KMnO4溶液检验乙烯,所以加入试剂的顺序是 ④⑤①③②或④⑤①②③,
故答案为:乙醇;消去反应;④⑤①③②或④⑤①②③;
(5)a.环己烷中只存在共价单键,所以属于饱和烃,故正确;
b.环氧乙烷与乙醛的分子式都是C2H4O,所以分子式相同,故正确;
c.E中含有氨基,所以能与盐酸反应,故错误;
d.F中含有羟基,所以可以发生酯化反应,故正确;
故选abd;
(6)以乙烯为原料可合成乙二酸二乙酯,要先制得乙醇和乙二酸,乙二酸可由乙烯通过加成、水解、氧化制得,乙醇可由乙烯与水加成制得,所以合成路线为
 ,
,故答案为:
 .
.
点评:本题涉及有机化合物之间的转化关系、官能团及性质、有机反应类型、有条件的同分异构体的书写、有机合成等相关知识,明确有机物的官能团及其性质是解本题关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组离子在指定条件下,一定能大量共存的是( )
| A、pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- |
| B、能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、NO3- |
| C、能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl- |
| D、水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、Cl-、NO3- |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1mol过氧化钠与水反应转移电子数为NA |
| B、0.1mol氯化铁水解制成胶体,所得胶体粒子数为0.1NA |
| C、标准状况下,22.4L水中含有水分子数为NA |
| D、1L 0.1mol每升乙酸溶液中氢离子数为0.1NA |
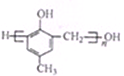 )的合成路线如下:
)的合成路线如下: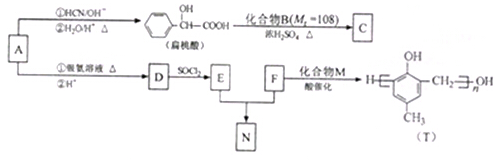
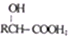

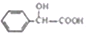 )有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有
)有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有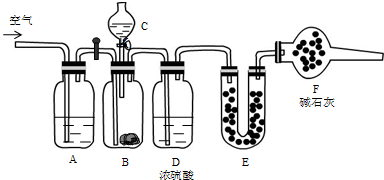
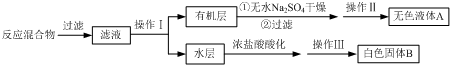

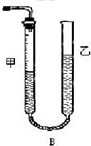 为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案.请回答每个方案中提出的问题.
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案.请回答每个方案中提出的问题.