题目内容
某含Na2O杂质的Na2O2试样,请设计实验测定该样品的纯度.
可供选择的装置如图:
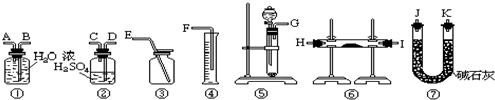
可供选择的药品:CaCO3固体,6mol/L盐酸,蒸馏水.
请回答下列问题:
(1)用上述装置可以组装一套最简单的测定过氧化钠样品纯度的实验装置,设计选择的仪器组合是 (填字母).
A.①②④⑤B.①④⑤C.⑤⑥⑦D.①③⑤⑦
(2)实验选择的药品是 ,所选用装置的连接顺序应是(填各接口的字母,连接胶管省略) (填字母)
(3)写出实验中Na2O2和Na2O分别发生反应的离子方程式: ;
(4)用上述实验后所得溶液配制成浓度为1.0mol/L的溶液.
①向400ml该溶液通入0.3molCO2,则所得溶液中C(HCO3-):C(CO32-)约为
A.1:3B.1:2 C.2:1 D.3:1
②有同学觉得选择上述实验装置会使测定的气体体积偏小,请写出一种你认为的可能原因:
(5)井下采煤个人用的自救器(类似呼吸面具)中盛放的也是过氧化钠,写出体现自救器自救功能的化学反应方程式: .
可供选择的装置如图:

可供选择的药品:CaCO3固体,6mol/L盐酸,蒸馏水.
请回答下列问题:
(1)用上述装置可以组装一套最简单的测定过氧化钠样品纯度的实验装置,设计选择的仪器组合是
A.①②④⑤B.①④⑤C.⑤⑥⑦D.①③⑤⑦
(2)实验选择的药品是
(3)写出实验中Na2O2和Na2O分别发生反应的离子方程式:
(4)用上述实验后所得溶液配制成浓度为1.0mol/L的溶液.
①向400ml该溶液通入0.3molCO2,则所得溶液中C(HCO3-):C(CO32-)约为
A.1:3B.1:2 C.2:1 D.3:1
②有同学觉得选择上述实验装置会使测定的气体体积偏小,请写出一种你认为的可能原因:
(5)井下采煤个人用的自救器(类似呼吸面具)中盛放的也是过氧化钠,写出体现自救器自救功能的化学反应方程式:
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)利用过氧化钠与水反应生成氧气,然后排水量气法测定氧气的体积,进而计算Na2O2试样的纯度;
(2)由(1)分析可知,需要的药品为蒸馏水;装置的组装顺序:固体混合物与水反应,用排水量气法测定氧气的体积,其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积;
(3)过氧化钠与是反应生成氢氧化钠与氧气,氧化钠与水反应生成氢氧化钠;
(4)①令碳酸氢钠、碳酸钠的物质的量分别为xmol、ymol,根据钠离子守恒、碳元素守恒解方程计算x、y的值;
②排水量气方法导气管中需要充满水分析;
(5)过氧化钠与二氧化碳反应生成碳酸钠与氧气.
(2)由(1)分析可知,需要的药品为蒸馏水;装置的组装顺序:固体混合物与水反应,用排水量气法测定氧气的体积,其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积;
(3)过氧化钠与是反应生成氢氧化钠与氧气,氧化钠与水反应生成氢氧化钠;
(4)①令碳酸氢钠、碳酸钠的物质的量分别为xmol、ymol,根据钠离子守恒、碳元素守恒解方程计算x、y的值;
②排水量气方法导气管中需要充满水分析;
(5)过氧化钠与二氧化碳反应生成碳酸钠与氧气.
解答:
解:(1)①利用过氧化钠与水反应生成氧气,然后排水量气法测定氧气的体积,进而计算Na2O2试样的纯度,故选择⑤①④,
故答案为:B;
(2)分析可知,需要的药品为蒸馏水;
装置的组装顺序:固体混合物与水反应,吸收生成的氧气中的水蒸气,用排水量气法测定氧气的体积,其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积,故连接顺序为:(G)接(A)(B)接(F),
故答案为:蒸馏水;(G)接(A)(B)接(F);
(3)Na2O2与是反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑,Na2O与水反应的离子方程式为2Na2O+2H2O═4Na++4OH-,
故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑、2Na2O+2H2O═4Na++4OH-;
(4)①令碳酸氢钠、碳酸钠的物质的量分别为xmol、ymol,根据钠离子守恒、碳元素守恒,则:
X+2Y=0.4×1 X+Y=0.3
解得x=0.2,y=0.1,
故所得溶液中HCO3-和CO32-的物质的量浓度之比约0.2mol:0.1mol=2:1,
故答案为:C;
②排水量气装置中导气管中无水,排水量气后充满水,会导致结果偏小,故答案为:实验前导管内无水,实验后导管内充满水;
(5)过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应方程式为:2Na2O2+2CO2═2 Na2CO3+O2,故答案为:2Na2O2+2CO2═2Na2CO3+O2.
故答案为:B;
(2)分析可知,需要的药品为蒸馏水;
装置的组装顺序:固体混合物与水反应,吸收生成的氧气中的水蒸气,用排水量气法测定氧气的体积,其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积,故连接顺序为:(G)接(A)(B)接(F),
故答案为:蒸馏水;(G)接(A)(B)接(F);
(3)Na2O2与是反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑,Na2O与水反应的离子方程式为2Na2O+2H2O═4Na++4OH-,
故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑、2Na2O+2H2O═4Na++4OH-;
(4)①令碳酸氢钠、碳酸钠的物质的量分别为xmol、ymol,根据钠离子守恒、碳元素守恒,则:
X+2Y=0.4×1 X+Y=0.3
解得x=0.2,y=0.1,
故所得溶液中HCO3-和CO32-的物质的量浓度之比约0.2mol:0.1mol=2:1,
故答案为:C;
②排水量气装置中导气管中无水,排水量气后充满水,会导致结果偏小,故答案为:实验前导管内无水,实验后导管内充满水;
(5)过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应方程式为:2Na2O2+2CO2═2 Na2CO3+O2,故答案为:2Na2O2+2CO2═2Na2CO3+O2.
点评:本题考查学生对实验原理的理解、实验方案的评价、化学计算等,综合性较大,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
下列各种变化中,不属于化学变化的是( )
| A、加热胆矾得到白色的无水硫酸铜粉末 |
| B、向鸡蛋溶液中滴入饱和硫酸钠溶液,析出白色沉淀 |
| C、向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体 |
| D、钢铁厂用热还原法冶炼铁 |
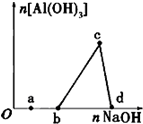 一定量的酸性AlCl3 溶液中逐滴加入NaOH溶液,生成沉淀Al(OH)3的量随NaOH加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
一定量的酸性AlCl3 溶液中逐滴加入NaOH溶液,生成沉淀Al(OH)3的量随NaOH加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A、a点对应的溶液中:K+、Ag+、Ca2+、NO3- |
| B、b点对应的溶液中:K+、NH4+、CO32-、SO42- |
| C、c点对应的溶液中:Na+、Fe3+、SO42-、HCO3- |
| D、d点对应的溶液中:Na+、S2-、SO42-、Cl- |
下列各组离子在指定条件下,一定能大量共存的是( )
| A、pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- |
| B、能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、NO3- |
| C、能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl- |
| D、水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、Cl-、NO3- |
用惰性电极电解水时为了增强其导电性不应加入的是( )
| A、NaOH |
| B、CuSO4 |
| C、H2SO4 |
| D、KNO3 |
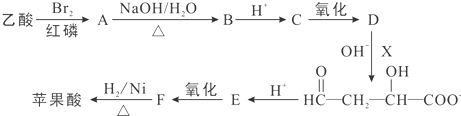
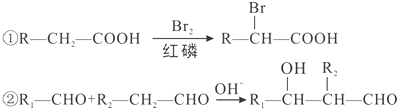
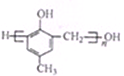 )的合成路线如下:
)的合成路线如下: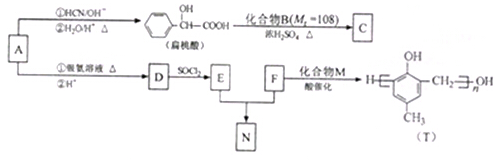
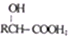

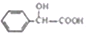 )有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有
)有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有
