题目内容
12.有两种盐A和B,A是白色固体,B是黑色固体,它们都跟稀H2SO4反应,其中物质A与稀H2SO4反应生成气体C,物质B与稀H2SO4反应生成气体D(D有臭鸡蛋气味).气体C和气体D混合后产生淡黄色固体E.把气体C通入足量的NaOH溶液中生成物质A.物质E跟铁在加热条件下反应生成物质B.试完成下列问题:完成下列反应的化学方程式:①物质A和稀H2SO4反应:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O.
②物质B和稀H2SO4反应:FeS+H2SO4═FeSO4+H2S↑.
③气体C和气体D反应:SO2+2H2S═3S↓+2H2O.
④物质E和铁反应:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS.
分析 黑色固体B与稀H2SO4反应生成有臭鸡蛋气味的气体D,D为H2S,B为硫化物,气体C和气体D混合后产生淡黄色固体E,物质E跟铁在加热条件下反应生成物质B,则E为S,B为FeS,物质A与稀H2SO4反应生成气体C,体C通入足量的NaOH溶液中生成物质A,则A为Na2SO3,C为SO2.
解答 解:黑色固体B与稀H2SO4反应生成有臭鸡蛋气味的气体D,D为H2S,B为硫化物,气体C和气体D混合后产生淡黄色固体E,物质E跟铁在加热条件下反应生成物质B,则E为S,B为FeS,物质A与稀H2SO4反应生成气体C,体C通入足量的NaOH溶液中生成物质A,则A为Na2SO3,C为SO2.
①物质A和稀H2SO4反应:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,
②物质B和稀H2SO4反应:FeS+H2SO4═FeSO4+H2S↑,
③气体C和气体D反应:SO2+2H2S═3S↓+2H2O,
④物质E和铁反应:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,
故答案为:①Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
②FeS+H2SO4═FeSO4+H2S↑;
③SO2+2H2S═3S↓+2H2O;
④Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS.
点评 本题考查无机物的推断,涉及硫元素单质化合物的性质,物质的颜色、气味是推断突破口,熟练掌握元素化合物知识.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| B. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| C. | 硅是人类将太阳能转换为电能的常用材料 | |
| D. | 由粗硅制备单晶硅不涉及氧化还原 |
3. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.试回答下列问题:
(1)滴定终点的现象:当滴入最后一滴盐酸时,锥形瓶中的溶液从红色变为无色,且半分钟内不变色
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是用待测溶液润洗锥形瓶由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是酸式滴定管用蒸馏水洗净后,应用标准液润洗
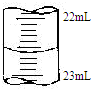
(5)如图是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)根据下列数据:
请计算待测烧碱溶液的浓度(保留四位小数)0.0800mol/L.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.试回答下列问题:
(1)滴定终点的现象:当滴入最后一滴盐酸时,锥形瓶中的溶液从红色变为无色,且半分钟内不变色
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是用待测溶液润洗锥形瓶由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是酸式滴定管用蒸馏水洗净后,应用标准液润洗
(5)如图是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
20.下列叙述正确的是( )
| A. | Fe 与S混合加热生成FeS | |
| B. | Fe与Cl2反应生成FeCl2 | |
| C. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| D. | 氯气具有漂白性 |
17.有机物M可从酸牛奶中提取.已知纯净的M为无色黏稠液体,易溶于水.为研究M的组成与结构,进行了如下实验:
| 实验步骤 | 解释或实验结论 |
| (1)称取M 4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空:(1)M的摩尔质量为:90g/mol. |
| (2)将此4.5g M在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g | (2)M的分子式为:C3H6O3. |
| (3)通过M的红外光谱图发现该分子中既有羟基,还有羧基(--COOH) | (3)写出M中含有官能团羟基的电子式: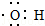 |
(4)M的核磁共振氢谱如图: | (4)M中含有4种氢原子. |
(5)综上所述,M的结构简式为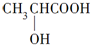 . . | |
1.25℃时,0.1mol/L稀醋酸加水稀释,如图坐标中的纵坐标y可以是( )
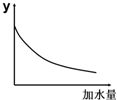

| A. | 溶液的pH | B. | 溶液的导电能力 | ||
| C. | 醋酸的电离平衡常数 | D. | 醋酸的c (OH-) |
2.X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻.Y的核电荷数是Z的核外电子数的一半,Y与M可形成化合物M2Y.下列说法正确的是( )
| A. | 还原性:X的氢化物>Y的氢化物>Z的氢化物 | |
| B. | X、Y、M三种元素可形成离子化合物 | |
| C. | 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 | |
| D. | Z元素的最高价氧化物的水化物的化学式为HZO4 |

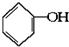 合成
合成 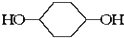 .(部分试剂和反应条件已略去)已知D为1,3-环己二稀
.(部分试剂和反应条件已略去)已知D为1,3-环己二稀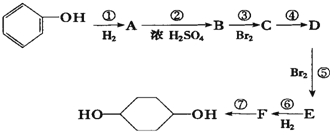

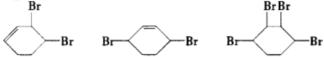 .
.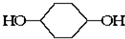 的一种同分异构体可发生银镜反应,也可以水解,核磁共振氢谱显示有三个峰,其面积比为1:2:9,该同分异构体的结构简式为HCOOCH2C(CH3)3
的一种同分异构体可发生银镜反应,也可以水解,核磁共振氢谱显示有三个峰,其面积比为1:2:9,该同分异构体的结构简式为HCOOCH2C(CH3)3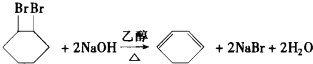 (有机物写结构简式,并注明反应条件)
(有机物写结构简式,并注明反应条件)