题目内容
1.25℃时,0.1mol/L稀醋酸加水稀释,如图坐标中的纵坐标y可以是( )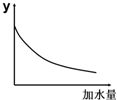
| A. | 溶液的pH | B. | 溶液的导电能力 | ||
| C. | 醋酸的电离平衡常数 | D. | 醋酸的c (OH-) |
分析 醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,溶液的导电能力与离子浓度成正比,温度不变,醋酸的电离平衡常数不变,据此分析解答.
解答 解:A.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度逐渐减少,溶液的pH逐渐增大,但始终小于7,故A错误;
B.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子、醋酸根离子浓度逐渐减少,溶液的导电能力逐渐减小,故B正确;
C.温度不变,醋酸的电离平衡常数不变,故C错误;
D.加水稀释溶液中氢离子浓度减小,则c (OH-)增大,故D错误;
故选B.
点评 本题考查了弱电解质的电离,明确加水稀释对醋酸电离程度的影响是解本题关键,知道溶液导电能力与离子浓度成正比,与电解质强弱无关,为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列说法正确的是( )
| A. | 摩尔是一种国际基本物理量 | |
| B. | 1mol氢气的质量为1g | |
| C. | 在同温同压下,相同体积的任何气体所含分子数相同 | |
| D. | 标准状况下,1mol任何物质的体积都约为22.4L |
16.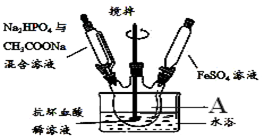 已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;
已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;
②磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色单斜晶体,溶于稀酸,不溶于水、乙醇、醋酸.
I.磷酸亚铁是生产LiFePO4电池的原料,实验室利用FeSO4•7H2O、Na2HPO4•12H2O及CH3COONa•3H2O为原料制备磷酸亚铁晶体,合成时的主要反应为:
3FeSO4+2Na2HPO4+2CH3COONa+8H2O=Fe3(PO4)2•8H2O↓+3Na2SO4+2CH3COOH
装置如图所示:
实验步骤:
①在50mL干净的仪器A中加入抗坏血酸(C6H8O6)稀溶液作底液;
②滴入足量Na2HPO4与CH3COONa混合溶液至pH=4;
③滴入含15.2g克FeSO4的溶液,最终维持pH=6,充分反应后静置;
④进行过滤和操作b,低温烘干得到磷酸亚铁晶体12.8克.
请回答下列问题:
(1)仪器A的名称是三颈烧瓶;
(2)配制FeSO4溶液时所用的蒸馏水应先进行的操作是煮沸除去水中的溶解的氧气.
(3)步骤④操作b的名称是洗涤,检验操作b是否完全的方法是取最后一次洗涤滤出液1-2mL于试管,滴入BaCl2溶液,若无白色沉淀,说明洗涤干净.
(4)抗坏血酸溶液的作用是防止磷酸亚铁被氧化.
(5)本实验的产率是76.5%(M[Fe3(PO4)2•8H2O]=502g•mol-1).
Ⅱ.水果和蔬菜中含有丰富的Vc,某研究性学习小组对它探究如下:
探究一:测定果汁中Vc的含量
分别向盛有lmL等浓度高锰酸钾稀溶液的四只试管中逐滴滴加梨汁、橙汁、苹果汁和0.04%的Vc溶液,边滴边振荡,直至高锰酸钾溶液褪色,测得以下数据:
(6)分析数据可知,三种果汁中Vc含量最高的是橙汁,其含量为0.02%;(各液体密度上的差别和每一滴的体积差别忽略不计).
探究二:蔬菜放置时间的长短对其Vc含量是否有影响
(7)请你用新鲜的西红柿、放置一周的西红柿、高锰酸钾稀溶液和必要的仪器设计实验方案:将新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液分别挤入两个烧杯中,向取有等量高锰酸钾稀溶液的两支试管中,分别滴入上述两种西红柿汁,边滴边振荡,直到高锰酸钾溶液刚好褪色,记录滴数..
 已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;
已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;②磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色单斜晶体,溶于稀酸,不溶于水、乙醇、醋酸.
I.磷酸亚铁是生产LiFePO4电池的原料,实验室利用FeSO4•7H2O、Na2HPO4•12H2O及CH3COONa•3H2O为原料制备磷酸亚铁晶体,合成时的主要反应为:
3FeSO4+2Na2HPO4+2CH3COONa+8H2O=Fe3(PO4)2•8H2O↓+3Na2SO4+2CH3COOH
装置如图所示:
实验步骤:
①在50mL干净的仪器A中加入抗坏血酸(C6H8O6)稀溶液作底液;
②滴入足量Na2HPO4与CH3COONa混合溶液至pH=4;
③滴入含15.2g克FeSO4的溶液,最终维持pH=6,充分反应后静置;
④进行过滤和操作b,低温烘干得到磷酸亚铁晶体12.8克.
请回答下列问题:
(1)仪器A的名称是三颈烧瓶;
(2)配制FeSO4溶液时所用的蒸馏水应先进行的操作是煮沸除去水中的溶解的氧气.
(3)步骤④操作b的名称是洗涤,检验操作b是否完全的方法是取最后一次洗涤滤出液1-2mL于试管,滴入BaCl2溶液,若无白色沉淀,说明洗涤干净.
(4)抗坏血酸溶液的作用是防止磷酸亚铁被氧化.
(5)本实验的产率是76.5%(M[Fe3(PO4)2•8H2O]=502g•mol-1).
Ⅱ.水果和蔬菜中含有丰富的Vc,某研究性学习小组对它探究如下:
探究一:测定果汁中Vc的含量
分别向盛有lmL等浓度高锰酸钾稀溶液的四只试管中逐滴滴加梨汁、橙汁、苹果汁和0.04%的Vc溶液,边滴边振荡,直至高锰酸钾溶液褪色,测得以下数据:
| 梨汁 | 苹果汁 | 橙汁 | 0.04%的Vc溶液 | |
| 滴加的滴数 | 40 | 20 | 10 | 5 |
探究二:蔬菜放置时间的长短对其Vc含量是否有影响
(7)请你用新鲜的西红柿、放置一周的西红柿、高锰酸钾稀溶液和必要的仪器设计实验方案:将新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液分别挤入两个烧杯中,向取有等量高锰酸钾稀溶液的两支试管中,分别滴入上述两种西红柿汁,边滴边振荡,直到高锰酸钾溶液刚好褪色,记录滴数..
13. 实验室以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸.反应式如下:
实验室以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸.反应式如下:

主要反应仪器如图1:
主要物质的物理常数如下表:
实验步骤如下:
①向反应容器中加入5.0g氢氧化钠、10.0mL水和15.0mL苯甲醛.开启搅拌器,加热回流约40min.
②停止加热,向反应物中加入足够量的水,不断摇动,使其中的苯甲酸盐全部溶解.冷却后将反应容器中的液体倒入分液漏斗,加入乙醚进行萃取、分液,得到上层溶液1和下层溶液2.上层溶液1可以经过图2两种方案得到苯甲醇.
③向下层溶液2中加入浓盐酸,并进行操作Ⅰ,得到苯甲酸.
根据以上步骤回答下列问题:
(1)仪器A的名称是球形冷凝管.
(2)上层溶液1蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热.油浴加热).蒸馏操作中,下列装置最好的是b(填标号).

(3)方案乙比方案甲得到的产品纯度更高,方案乙洗涤时先后用到了饱和NaHSO3溶液、10%的Na2CO3溶液和水.
a.饱和NaHSO3溶液的作用是除去苯甲醛.
b.加入10%的Na2CO3溶液至无气泡产生时说明杂质已被除尽.
(4)蒸馏获得苯甲醇操作时温度应控制在205.7℃左右.获得苯甲酸时进行的操作Ⅰ的名称是过滤.
(5)若制得苯甲酸的质量为7.50g.则苯甲酸的产率是81.97%.
 实验室以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸.反应式如下:
实验室以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸.反应式如下:
主要反应仪器如图1:
主要物质的物理常数如下表:
| 名称 | 分子量 | 性状 | 相对密度 (g•cm-3) | 熔点 (℃) | 沸点 (℃) | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 179.6 | 微溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 针状结晶 | 1.27 | 122.1 | 249 | 0.21g | 46.6g | 66g |
| 苯甲醇 | 108 | 无色液体 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 | 易溶 |
| 乙醚 | 74 | 无色液体 | 0.71 | -116.3 | 34.6 | 不溶 | 易溶 | 一 |
①向反应容器中加入5.0g氢氧化钠、10.0mL水和15.0mL苯甲醛.开启搅拌器,加热回流约40min.
②停止加热,向反应物中加入足够量的水,不断摇动,使其中的苯甲酸盐全部溶解.冷却后将反应容器中的液体倒入分液漏斗,加入乙醚进行萃取、分液,得到上层溶液1和下层溶液2.上层溶液1可以经过图2两种方案得到苯甲醇.
③向下层溶液2中加入浓盐酸,并进行操作Ⅰ,得到苯甲酸.
根据以上步骤回答下列问题:
(1)仪器A的名称是球形冷凝管.
(2)上层溶液1蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热.油浴加热).蒸馏操作中,下列装置最好的是b(填标号).

(3)方案乙比方案甲得到的产品纯度更高,方案乙洗涤时先后用到了饱和NaHSO3溶液、10%的Na2CO3溶液和水.
a.饱和NaHSO3溶液的作用是除去苯甲醛.
b.加入10%的Na2CO3溶液至无气泡产生时说明杂质已被除尽.
(4)蒸馏获得苯甲醇操作时温度应控制在205.7℃左右.获得苯甲酸时进行的操作Ⅰ的名称是过滤.
(5)若制得苯甲酸的质量为7.50g.则苯甲酸的产率是81.97%.
10.下列有机物的同分异构体数目(不考虑立体异构)由小到大的顺序是( )
| 序号 | ① | ② | ③ |
| 分子式 | C9H12 | C3H7OCl | C5H12O |
| 限定条件 | 芳香烃 | 含有羟基 | 不能与Na反应放出氢气 |
| A. | ③②① | B. | ②③① | C. | ③①② | D. | ②①③ |
 H2PO4-+H+.
H2PO4-+H+.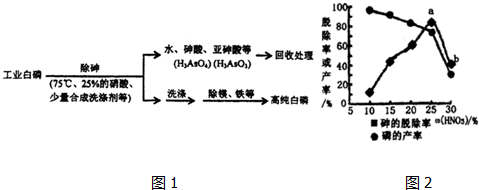
 肉桂酸(C6H5CH=CHCOOH)是一种常用的香料,可从桂皮中提取,还可用甲苯、氯气等为原料按如下路线合成:
肉桂酸(C6H5CH=CHCOOH)是一种常用的香料,可从桂皮中提取,还可用甲苯、氯气等为原料按如下路线合成:
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.