题目内容
11.有资料介绍Fe3+在水溶液中通常以水合离子形式存在,[Fe(H2O)6]3+几乎无色.某化学实验小组对实验室Fe(NO3)3和FeCl3溶液呈黄色的原因产生了疑问,进一步查阅资料发现:①[Fe(H2O)6]3++H2O?[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=1~6);
②[FeCl4(H2O)2]-为黄色.
他们进行了如下探究实验.请回答下列问题:
【实验Ⅰ】(图1)
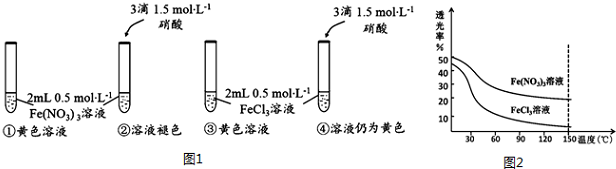
(1)你认为Fe(NO3)3溶液呈黄色的原因是[Fe(H2O)6]3+水解产生了[Fe(H2O)6-n(OH)n]3-n.
(2)你认为FeCl3溶液呈黄色主要是含有[FeCl4(H2O)2]-微粒,理由:试管②、④中加入等量的HNO3后,②中溶液褪色,而④中溶液仍呈黄色.
【实验Ⅱ】
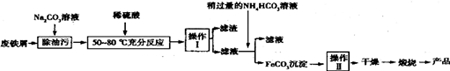
已知透光率越大,溶液颜色越浅.用色度计分别测定0.5mol•L-1 Fe(NO3)3和FeCl3溶液在不同温度下的透光率如图2所示.
(3)随着温度升高,Fe(NO3)3溶液透光率逐渐减小的原因是温度升高,导致平衡[Fe(H2O)6]3++nH2O?[Fe(H2O)6-n(OH)n]3-n+nH3O+正向移动,[Fe(H2O)6-n(OH)n]3-n浓度增大,溶液颜色加深.
(4)FeCl3溶液透光率随温度升高而减小的幅度明显大于Fe(NO3)3溶液,其原因用离子方程式表示:[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O,该反应属于吸热反应(填“放热”或“吸热”).
【实验Ⅲ】
该实验小组同学还设计了一个实验方案验证(4)中结论.
(5)取试管②中无色溶液,滴加几滴B(从下列选项中选择最佳试剂,填写字母序号),通过现象能证明(4)中结论正确.
A.Fe(NO3)3溶液 B.NaCl溶液 C.NaNO3溶液 D.FeCl3溶液.
分析 (1)实验①②对比,硝酸铁溶液加入硝酸溶液,溶液中氢离子浓度增大,而溶液黄色褪去,信息①中平衡向左移动,硝酸铁溶液溶液黄色是[Fe(H2O)6-n(OH)n]3-n所致;
(2)实验②④对比,氯化铁溶液中加入硝酸,溶液黄色不变,氯化铁溶液黄色为[FeCl4(H2O)2]-所致;
(3)随着温度升高,Fe(NO3)3溶液透光率逐渐减小,说明溶液中[Fe(H2O)6-n(OH)n]3-n浓度增大;
(4)升高温度溶液中[FeCl4(H2O)2]-浓度增大;
(5)加入含有氯离子物质,由平衡移动增大溶液中[FeCl4(H2O)2]-浓度.
解答 解:(1)实验①②对比,硝酸铁溶液加入硝酸溶液,溶液中氢离子浓度增大,而溶液黄色褪去,信息①中平衡向左移动,硝酸铁溶液溶液黄色是[Fe(H2O)6]3+水解产生了[Fe(H2O)6-n(OH)n]3-n所致,
故答案为:[Fe(H2O)6]3+水解产生了[Fe(H2O)6-n(OH)n]3-n;
(2)试管②、④中加入等量的HNO3后,②中溶液褪色,而④中溶液仍呈黄色,说明氯化铁溶液黄色为[FeCl4(H2O)2]-所致,
故答案为:[FeCl4(H2O)2]-; 试管②、④中加入等量的HNO3后,②中溶液褪色,而④中溶液仍呈黄色;
(3)温度升高,导致平衡[Fe(H2O)6]3++nH2O?[Fe(H2O)6-n(OH)n]3-n+nH3O+正向移动,[Fe(H2O)6-n(OH)n]3-n浓度增大,溶液颜色加深,Fe(NO3)3溶液透光率逐渐减小,
故答案为:温度升高,导致平衡[Fe(H2O)6]3++nH2O?[Fe(H2O)6-n(OH)n]3-n+nH3O+正向移动,[Fe(H2O)6-n(OH)n]3-n浓度增大,溶液颜色加深;
(4)升高温度溶液中[FeCl4(H2O)2]-浓度增大,促进[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O 正向进行,正反应为吸热反应,
故答案为:[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O;吸热;
(5)对照实验②④可知,向②的溶液中加入含有氯离子物质,增大溶液中[FeCl4(H2O)2]-浓度,可以证明实验方案验证(4)中结论,由于D中氯化铁溶液本身含有[FeCl4(H2O)2]-,不能选用,
故答案为:B.
点评 本题考查了对探究实验方案分析评价、信息获取与迁移运用,注意充分利用对照实验进行分析,是对现实综合能力的考查,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 原子数相同 | B. | 中子数相同 | C. | 质子数相同 | D. | 气体质量不相同 |

| A. | 该有机物的化学式为C12H12O6 | |
| B. | 1mol该有机物最多可以和3molNaOH反应 | |
| C. | 该有机物容易发生加成、取代、消去等反应 | |
| D. | 该有机物可代替KSCN检验Fe3的存在 |
 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡.该反应中CO2的平衡转化率随温度的变化曲线如图所示.下列说法正确的是( )
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡.该反应中CO2的平衡转化率随温度的变化曲线如图所示.下列说法正确的是( )| A. | 反应2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)的△S<0、△H<0 | |
| B. | 表示乙容器CO2的平衡转化率随温度变化的是曲线B | |
| C. | 体系中c(CH3OCH3):c(CH3OCH3,状态Ⅱ)<2c(CH3OCH3,状态Ⅲ) | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)<v逆(状态Ⅲ) |
| A. | 除去乙烷中少量的乙烯:与氢气混合加热,把乙烯转化为乙烷 | |
| B. | 除去苯中的少量乙烯:加入浓溴水振荡静置后过滤,除去二溴乙烯 | |
| C. | 为加快反应速率,制乙炔时用食盐水代替水 | |
| D. | 提取碘水中的碘,加入CCl4振荡静置分层后,取出有机层再分离 |
| A. | 1:9 | B. | 9:1 | C. | 1:11 | D. | 11:1 |
 .
.
 HCO3-+OH-;
HCO3-+OH-;