题目内容
19.NM-3是处于临床试验阶段的小分子抗癌药物,分子结构如图.下列说法正确的是( )
| A. | 该有机物的化学式为C12H12O6 | |
| B. | 1mol该有机物最多可以和3molNaOH反应 | |
| C. | 该有机物容易发生加成、取代、消去等反应 | |
| D. | 该有机物可代替KSCN检验Fe3的存在 |
分析 该有机物中含有-COOH,具有酸性,可发生酯化反应,含有C=C,可发生加成反应,含有酚羟基,可与FeC13溶液发生显色反应,其中能与NaOH反应的官能团有-COOH、-COO-以及酚羟基.
解答 解:A.1个分子中含有10个H原子,则分子式为C12H10O6,故A错误;
B.-COOH、酚-OH、-COOC-均能与碱反应,则1mol该有机物最多可以和4molNaOH反应,故B错误;
C.有机物含C=C及酚-OH,该有机物容易发生加成、取代反应,但不能发生消去反应,故C错误;
D.含有酚羟基,可与铁离子发生颜色反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高考常见题型,注意把握有机物中的官能团,熟悉烯烃、酯类、酚的性质即可解答,题目难度不大.

练习册系列答案
相关题目
9.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,金属性最强的元素是K,最活泼的非金属元素是F;化学性质最不活泼的元素是Ar.
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3
(3)在③~⑦元素中,原子半径最大的是Na;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.与⑩元素同主族下一周期元素的一种化合物是食用盐中必须加入的,此化合物的化学式KIO3.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3
(3)在③~⑦元素中,原子半径最大的是Na;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.与⑩元素同主族下一周期元素的一种化合物是食用盐中必须加入的,此化合物的化学式KIO3.
10.砹(At)是卤素中核电荷数最大的元素,推测砹或砹的化合物性质的叙述中正确的是( )
| A. | 砹为有色固体 | |
| B. | HAt 很稳定 | |
| C. | AgAt易溶于水 | |
| D. | 砹单质的熔沸点比碘单质的熔沸点低 |
7.下列属于吸热反应的是( )
| A. | 铝与盐酸反应 | B. | Ba(OH)2?8H2O和NH4Cl固体反应 | ||
| C. | 盐酸和氢氧化钠的中和反应 | D. | 氢气的燃烧反应 |
14.下列说法正确的是( )
| A. | 向Na2S03溶液中加入硝酸酸化的BaCl2,有白色沉淀出现,说明Na2S03溶液已经变质 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 等体积、pH都为3的酸HCl和CH3COOH分别与足量的锌反应,放出的氢气一样多 | |
| D. | 硫酸铁可用于净水,因为三价铁离子可水解生成Fe(OH)3沉淀 |
8.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分,下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
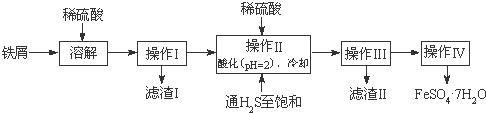
查询资料,得25℃时有关物质的数据如下表:
(1)操作II中,先通入硫化氢至饱和的目的是使Fe3+还原成Fe2+,并使Sn2+离子完全沉淀,后加入硫酸酸化至pH=2的作用是防止Fe2+离子生成沉淀.
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
③若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是部分Fe2+被空气中O2氧化;
④该绿矶产品中绿矾的质量分数为97.54%.

查询资料,得25℃时有关物质的数据如下表:
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
③若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是部分Fe2+被空气中O2氧化;
④该绿矶产品中绿矾的质量分数为97.54%.
13.设NA表示阿伏加德罗常数的值,下列表述不正确的是( )
| A. | 1 mol•L-1 的硫酸钾溶液中K+数为2NA | |
| B. | 3.2g氧气所含的原子数为0.2NA | |
| C. | 标准状况下,22.4L氢气所含质子数是2NA | |
| D. | 常温常压下,32g O2和32g O3所含氧原子数都是2NA |
 按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.
按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.