题目内容
1.对于AZ Xnm-、A代表质量数,若它的n=1,m=0,Z=15,N=16,对应的核素粒子的符号为3115P,若它的n=1,m=1,核外有18个电子,则其Z=17,此离子的电子式 .
.
分析 质量数=质子数+中子数,阴离子的核外电子数=原子的质子数+电荷数,氯离子为阴离子,电子式中需要标出最外层所带电荷,据此解题.
解答 解:质量数=质子数+中子数=16+16=31,核素粒子的符号为3115P;Z=18-1=17,为氯元素,氯离子的电子式为: ,
,
故答案为:3115P;17; .
.
点评 本题考查质子数、中子数、核外电子数及其相互联系,题目难度中等,注意掌握离子的电子式、元素符号等化学用语的概念及书写原则,试题培养了学生灵活应用基础知识的能力和规范答题能力.

练习册系列答案
相关题目
11.根据“金刚石?石墨+1.896kJ”,可以得出的正确结论是( )
| A. | 石墨的能量比金刚石低 | B. | 石墨和金刚石都是碳的同位素 | ||
| C. | 金刚石转化为石墨是物理变化 | D. | 金刚石比石墨更稳定 |
12.优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2一乙烯吡啶(简写P2VP)和I2 的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为2Li+P2VP•nI2═P2VP•(n-1)I2+2LiI,则下列说法正确的是( )
| A. | 聚2一乙烯吡啶的复合物与有机物性质相似,因此聚2一乙烯吡啶的复合物不会导电 | |
| B. | 正极的反应为P2VP•nI2+2Li++2e-═P2VP•(n-1)I2+2LiI | |
| C. | 电池工作时,碘离子移向P2VP一极 | |
| D. | 该电池所产生的电压低,使用寿命比较短 |
9.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,金属性最强的元素是K,最活泼的非金属元素是F;化学性质最不活泼的元素是Ar.
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3
(3)在③~⑦元素中,原子半径最大的是Na;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.与⑩元素同主族下一周期元素的一种化合物是食用盐中必须加入的,此化合物的化学式KIO3.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3
(3)在③~⑦元素中,原子半径最大的是Na;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.与⑩元素同主族下一周期元素的一种化合物是食用盐中必须加入的,此化合物的化学式KIO3.
16.2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德•埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )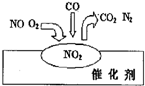

| A. | NO2是该过程的最终产物 | |
| B. | NO和O2必须在催化剂表面才能反应 | |
| C. | 汽车尾气的主要污染成分是CO2和NO | |
| D. | 该催化转化的总反应方程式为:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$ 4CO2+N2 |
6.物质的量浓度相同的下列溶液中,c(NH4+)最大的是( )
| A. | NH4Cl | B. | (NH4)2SO4 | C. | NH4HSO4 | D. | NH4HCO3 |
13.在由水电离产生的c(H+)=1×10-14mol/L的无色溶液中,一定可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、SO42- | B. | K+、Cu2+、Cl-、NO3- | ||
| C. | NH4+、Al3+、Br-、SO42- | D. | Na+、Ba2+、Cl-、NO3- |
10.砹(At)是卤素中核电荷数最大的元素,推测砹或砹的化合物性质的叙述中正确的是( )
| A. | 砹为有色固体 | |
| B. | HAt 很稳定 | |
| C. | AgAt易溶于水 | |
| D. | 砹单质的熔沸点比碘单质的熔沸点低 |