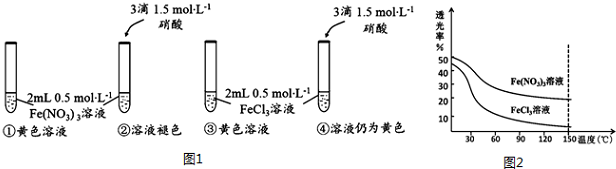
题目内容
16.元素A的阳离子mAa+与元素B的阴离子nBb-具有相同的电子层结构.以下关于A、B元素性质的比较中,正确的是①②④.①原子序数:A>B ②原子半径:A>B ③离子半径:Aa+>Bb-
④原子最外层电子数:B>A ⑤m+a=n-b ⑥a=8-b.
分析 元素A的阳离子mAa+与元素B的阴离子nBb-具有相同的电子层结构,即两种离子核外电子数相同,且A元素位于B元素下一周期,
①离子的原子序数等于其核内质子数;
②原子电子层数越多,其原子半径越大;
③电子层结构相同的离子,离子半径随着原子序数增大而减小;
④金属元素最外层电子数小于4,非金属元素最外层电子数等于或大于4;
⑤阳离子核外电子数=质子数-电荷数,阴离子核外电子数=质子数+电荷数;
⑥a+b不等于8而小于8.
解答 解:元素A的阳离子mAa+与元素B的阴离子nBb-具有相同的电子层结构,即两种离子核外电子数相同,且A元素位于B元素下一周期,
①离子的原子序数等于其核内质子数,所以A原子序数是m、B原子序数是n,A在B元素下一周期,所以原子序数A>B,故正确;
②原子电子层数越多,其原子半径越大,A原子电子层数大于B,所以原子半径A>B,故正确;
③电子层结构相同的离子,离子半径随着原子序数增大而减小,原子序数A>B,所以离子半径A<B,故错误;
④金属元素最外层电子数小于4,非金属元素最外层电子数等于或大于4,所以原子最外层电子数B>A,故正确;
⑤阳离子核外电子数=质子数-电荷数,阴离子核外电子数=质子数+电荷数,两种离子核外电子数相等,所以m-a=n+b,故错误;
⑥a+b不等于8而是小于8,a、b都可能是1、2或3,所以a与b的和一定不等于8,故错误;
故选①②④.
点评 本题考查原子结构和元素周期律,为高频考点,明确原子结构、元素周期律是解本题关键,知道阴阳离子核外电子数计算方法,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.物质的量浓度相同的下列溶液中,c(NH4+)最大的是( )
| A. | NH4Cl | B. | (NH4)2SO4 | C. | NH4HSO4 | D. | NH4HCO3 |
7.下列属于吸热反应的是( )
| A. | 铝与盐酸反应 | B. | Ba(OH)2?8H2O和NH4Cl固体反应 | ||
| C. | 盐酸和氢氧化钠的中和反应 | D. | 氢气的燃烧反应 |
1.硫铁矿(主要成分为FeS2)又称愚人金,用如图所示装置定量测定其硫元素的质量分数.取m g该样品于装置A中,经充分锻烧反应,使硫元素全部转化为氧化物,用B装置完全吸收;将煅烧后A中固体用盐酸溶解得溶液W,经检验W中含有Fe2+和Fe3+.计算硫元素的质量分数还应测量的数据是( )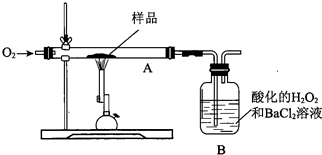

| A. | 测B中沉淀质量 | B. | 测锻烧后A中固体的质量 | ||
| C. | 测B吸收瓶反应前的质量 | D. | 将W蒸干、灼烧,测所得固体质量 |
8.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分,下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
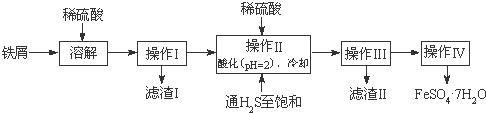
查询资料,得25℃时有关物质的数据如下表:
(1)操作II中,先通入硫化氢至饱和的目的是使Fe3+还原成Fe2+,并使Sn2+离子完全沉淀,后加入硫酸酸化至pH=2的作用是防止Fe2+离子生成沉淀.
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
③若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是部分Fe2+被空气中O2氧化;
④该绿矶产品中绿矾的质量分数为97.54%.

查询资料,得25℃时有关物质的数据如下表:
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
③若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是部分Fe2+被空气中O2氧化;
④该绿矶产品中绿矾的质量分数为97.54%.
10.下列实验操作或实验事故的处理正确的是( )
| A. | 做钠盐溶液的焰色反应时,用铂丝蘸取溶液放在酒精灯火焰上灼烧 | |
| B. | 分液时,下层液体先从分液漏斗下口放出,换一个接收容器,再将上层液体从分液漏斗下口放出 | |
| C. | 浓NaOH溶液沾到皮肤上,先用稀硫酸冲洗,再用水冲洗 | |
| D. | 用氨水清洗做过银镜反应的试管内壁 |
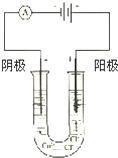 按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.
按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.