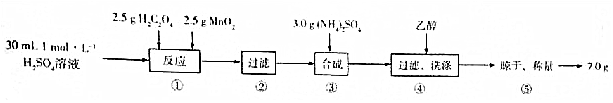
题目内容
12.下列物质中含有非极性键的共价化合物是( )| A. | 氯气 | B. | 过氧化氢 | C. | 过氧化钠 | D. | 氯化氢 |
分析 共价键是属于非金属元素之间形成的化学键,其中相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键,只含有共价键的化合物是为共价化合物,以此来解答.
解答 解:A.Cl2是单质,不是共价化合物,故A不选;
B.H2O2既含有非极性共价键,又含有极性共价键,为共价化合物,故B选;
C.Na2O2既含有非极性共价键,又含有离子键,为离子化合物,故不C选;
D.HCl中只含H-Cl极性共价键,故D不选;
故选B.
点评 本题考查共价键,把握化学键的形成及判断的一般规律为解答的关键,注意共价化合物只含有共价键,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
2.实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )
| A. | 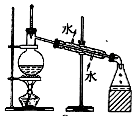 装置常用于分离互不相溶的液体混合物 | |
| B. | 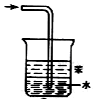 装置可用于吸收氨气,且能防止倒吸 | |
| C. | 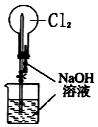 用装置不可以完成“喷泉”实验 | |
| D. | 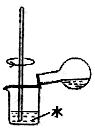 用装置稀释浓硫酸和铜反应冷却后的混合液 |
3.在反应3Cl2+2FeBr2═2FeCl3+2Br2中被还原的元素是( )
| A. | Fe | B. | Fe和Cl | C. | Cl | D. | Br |
20.实验室制Cl2的反应为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.下列说法错误的( )
| A. | 还原剂是HCl,氧化剂是MnO2 | |
| B. | 每消耗1 mol HCl,转移电子的物质的量为2 mol | |
| C. | 每生成1 mol Cl2,转移电子的物质的量为2 mol | |
| D. | 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
17.天然存在的金属钫(Fr)极微量,它的21个已知同位素都有放射性,它是碱金属元素中最重的元素.根据它在周期表中的位置语言其性质,其中不正确的是( )
| A. | 在已知元素中具有最大的原子半径 | B. | 其单质的熔点比金属钠的熔点高 | ||
| C. | 氧化物对应的水化物是极强的碱 | D. | 金属钫与氧气或水反应非常剧烈 |
4.下列有关说法不正确的是( )
| A. | 任何烷烃分子中碳氢原子个数比都是相同的 | |
| B. | 烷烃的沸点随碳原子数增加而逐渐升高 | |
| C. | 丙烷与Cl2发生取代反应后生成的一氯代物不只是一种 | |
| D. | 正丁烷的熔点、沸点比异丁烷的高 |
1.下列物质中,既含有离子键,又含极性共价键的是( )
| A. | K2S | B. | NaOH | C. | Al2O3 | D. | Na2O2 |