题目内容
4.下列有关说法不正确的是( )| A. | 任何烷烃分子中碳氢原子个数比都是相同的 | |
| B. | 烷烃的沸点随碳原子数增加而逐渐升高 | |
| C. | 丙烷与Cl2发生取代反应后生成的一氯代物不只是一种 | |
| D. | 正丁烷的熔点、沸点比异丁烷的高 |
分析 A.烷烃的通式是CnH(2n+2),不同烷烃中碳氢原子个数比不同;
B.烷烃都是分子晶体,熔沸点取决于分子间作用力,分子间作用力随着分子量的增大而增大,分子量又随着碳原子数的增多而增大;
C.丙烷有两种不同环境的氢原子,所以一氯代物有两种;
D.碳原子数相同的烃,支链越多熔沸点越低.
解答 解:A.根据烷烃的通式可知,$\frac{N(C)}{N(H)}$=$\frac{n}{2n+2}$,任何烷烃分子中碳氢原子个数比都是不相同的,故A错误;
B.烷烃熔沸点取决于分子间作用力.碳原子数越多,分子量越大,分子间作用力越强,熔沸点越高,故B正确;
C.丙烷的一氯取代物有两种,故C正确;
D.正丁烷、异丁烷碳原子数相同,异丁烷有支链,正丁烷无支链,异丁烷沸点低,正丁烷的熔点、沸点比异丁烷的高,故D正确;
故选A.
点评 本题考查了烷烃的结构和物理性质,题目难度不大,注意烷烃沸点高低的规律.

练习册系列答案
相关题目
14.向某溶液中投入铝片后有大量H2放出,则溶液中不可能大量存在的离子是( )
| A. | Cl- | B. | Na+ | C. | NO3- | D. | HCO-3 |
15.能够证明某卤代烃中存在氯元素的操作及现象是( )
| A. | 在卤代烃中直接加入稀硝酸酸化的AgNO3溶液,产生白色沉淀 | |
| B. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液,产生白色沉淀 | |
| C. | 加蒸馏水,充分搅拌后,加入AgNO3溶液,产生白色沉淀 | |
| D. | 加入NaOH溶液,加热一段时间后冷却,加入稀硝酸酸化,然后加入AgNO3溶液,产生白色沉淀 |
12.下列物质中含有非极性键的共价化合物是( )
| A. | 氯气 | B. | 过氧化氢 | C. | 过氧化钠 | D. | 氯化氢 |
19.几种短周期元素的原子半径及主要化合价如表:
已知X是短周期中最活泼的金属,且与R同周期.下列叙述不正确的是( )
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Z与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | 含元素R的某种盐可作净水剂 |
16.多年来世界发达国家的科研和生产实践已证明氢能是摆脱对石油依赖的最经济有效的能源,有关专家甚至认为氢能将是主宰未来世界的主要能源.目前有人研究出将淀粉或纤维素、水在酶作用下转变为二氧化碳和氢气的方法来制取氢气.下列说法错误的是( )
| A. | 上述制氢气的反应式可表示为:(C6H10O5)n+7nH2O$\stackrel{酶}{→}$6nCO2↑+12nH2↑ | |
| B. | 从整个能量循环来看,利用该方法得到的氢能来源于光能 | |
| C. | 酶作为催化剂需要合适的温度 | |
| D. | 氢元素有3种核素,形成的H2分子有3种 |
13.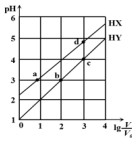 在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
 在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )| A. | a、b两点的溶液中:c(X-)>c(Y-) | |
| B. | 相同温度下,电离常数K(HX):d>a | |
| C. | 溶液中水的电离程度:d>c>b>a | |
| D. | lg$\frac{V}{{V}_{0}}$=2时,若同时微热两种液体(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$ 增大 |
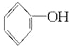 +2Na→2
+2Na→2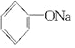 +H2↑
+H2↑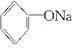 +H2O.
+H2O.