题目内容
1.下列物质中,既含有离子键,又含极性共价键的是( )| A. | K2S | B. | NaOH | C. | Al2O3 | D. | Na2O2 |
分析 一般来说,活泼金属元素与活泼非金属元素形成离子键,非金属元素之间形成共价键,以此来解答.
解答 解:A.K2S中只含离子键,故A不选;
B.NaOH中含钠离子与氢氧根离子形成离子键,O与H形成极性共价键,故B选;
C.氧化铝中铝离子和氧离子之间只存在离子键,故C不选;
D.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,故D不选;
故选B.
点评 本题考查化学键,把握离子键、共价键判断的一般规律为解答的关键,注意特殊物质中的化学键(氯化铝、铵盐等),题目难度不大.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
11.下列说法正确的是( )
| A. | 实验桌上的酒精灯倾倒并燃烧起来,应马上用水扑灭 | |
| B. | 分液操作时,分液漏斗中的下层液体从下口放出后再将上层液体从下口放出到另一烧杯中 | |
| C. | 用试管夹从试管底由下往上夹住距离管口约$\frac{1}{3}$处,手持试管夹长柄末端进行加热 | |
| D. | 为检验某溶液中是否含有NH4+,可在此溶液中加入足量的NaOH溶液,加热后用湿润的蓝色石蕊试纸检验 |
12.下列物质中含有非极性键的共价化合物是( )
| A. | 氯气 | B. | 过氧化氢 | C. | 过氧化钠 | D. | 氯化氢 |
16.多年来世界发达国家的科研和生产实践已证明氢能是摆脱对石油依赖的最经济有效的能源,有关专家甚至认为氢能将是主宰未来世界的主要能源.目前有人研究出将淀粉或纤维素、水在酶作用下转变为二氧化碳和氢气的方法来制取氢气.下列说法错误的是( )
| A. | 上述制氢气的反应式可表示为:(C6H10O5)n+7nH2O$\stackrel{酶}{→}$6nCO2↑+12nH2↑ | |
| B. | 从整个能量循环来看,利用该方法得到的氢能来源于光能 | |
| C. | 酶作为催化剂需要合适的温度 | |
| D. | 氢元素有3种核素,形成的H2分子有3种 |
6.X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期.下列说法错误的是( )
| A. | 原子半径:Z>R>Y | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | Y、Z、R三种元素组成的化合物水溶液一定显中性 | |
| D. | X2W6分子中各原子均满足8电子结构 |
13.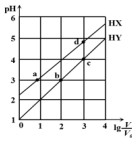 在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
 在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )| A. | a、b两点的溶液中:c(X-)>c(Y-) | |
| B. | 相同温度下,电离常数K(HX):d>a | |
| C. | 溶液中水的电离程度:d>c>b>a | |
| D. | lg$\frac{V}{{V}_{0}}$=2时,若同时微热两种液体(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$ 增大 |
10.下列实验操作正确的是( )
| A. | 用容量瓶配制溶液时,先用蒸馏水洗涤,再用待装溶液润洗 | |
| B. | 用湿润的红色石蕊试纸检验酸性气体 | |
| C. | 用烧杯加热分解Al(OH)3固体 | |
| D. | 用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液 |
15.下列关于有机物的说法正确的是( )
| A. | 丙烷与2-甲基丙烷的一氯代物均为两种 | |
| B. | 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应 | |
| C. | 乙醇和乙酸都能与碳酸氢钠溶液反应 | |
| D. | 富含糖类和蛋白质的物质都易被人体消化 |