题目内容
18.在一定温度下,对可逆反应A(g)+3B(g)?4C(g)的下列叙述中,能说明反应已经达到达到平衡的是( )| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内amol A生成,同时生成3amol B | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的平均相对分子质量不变 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A.当C的生成速率与C的分解速率相等时,该反应达到平衡状态,故A正确;
B.反应速率之比等于化学方程式计量数之比,单位时间内amol A生成,同时生成3amol B,只能说明反应逆向进行,不能说明反应达到平衡状态,故B错误;
C.该反应是一个反应前后气体体积不变的可逆反应,容器内压强始终不变,所以不能据此判断该反应是否达到平衡状态,故C错误;
D.该反应是一个反应前后气体体积不变的可逆反应,所以混合气体的质量、物质的量始终不变,混合气体的平均相对分子质量始终不变,所以不能据此判断该反应是否达到平衡状态,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,注意该反应是一个反应前后气体体积不变的可逆反应,如果温度和容器的体积不变,则气体相对分子质量、压强始终不变,题目难度不大.

练习册系列答案
相关题目
9.金属单质具有的通性是( )
| A. | 硬度大 | |
| B. | 熔、沸点较低 | |
| C. | 质软 | |
| D. | 具有金属光泽、导电、导热、有延展性 |
6.T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的物质的量变化如图-1所示;若保持其他条件不变,温度分别为T1和T2,Y的体积百分含量与时间的关系如图-2所示.下列分析正确的是( )
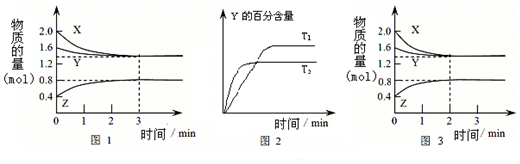

| A. | 容器中发生的反应可表示为:2X(g)+Y(g)?2Z(g) | |
| B. | 0~3 min内,v(X)=0.2 mol•L-1•min-1 | |
| C. | 其他条件不变升高温度,v正、v逆都增大,且重新平衡前v正>v逆 | |
| D. | 若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
2.下列叙述中正确的是( )
| A. | 体积相同、浓度均为0.1 mol•L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n | |
| B. | 有甲、乙两氨水溶液,测得甲的pH=a,乙的pH=a+1,则甲乙两溶液c(H+)之比为10:1 | |
| C. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中c(H+)之比为2:1 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,K=$\frac{c{α}^{2}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,K变小 |
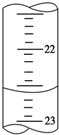 某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下:
某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下: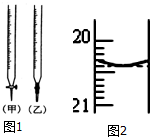 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题: