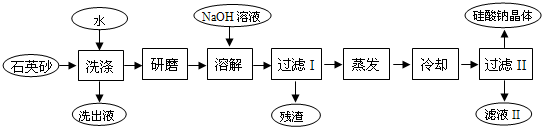
题目内容
9.金属单质具有的通性是( )| A. | 硬度大 | |
| B. | 熔、沸点较低 | |
| C. | 质软 | |
| D. | 具有金属光泽、导电、导热、有延展性 |
分析 根据金属的物理通性;金属都具有一定的金属光泽,导电,导热,有延展性;有的金属质软,熔沸点较低,有的金属硬度大,熔沸点较高,据此分析解答.
解答 解:由金属的物理性质可知,大多数金属具有金属光泽,在室温下除汞外,金属都是固体,密度和硬度较大,熔点和沸点较高,具有良好的导电性,导热性和延展性,但有的金属质软,熔沸点较低,如金属钠,
故选:D.
点评 本题主要考查金属的物理通性,解答本题要熟记和理解金属的物理性质,题目难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
19.次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性.下列有关说法正确的是( )
| A. | 用惰性电极电解NaH2PO2溶液,其阴极反应式为:2H2O-4e-═O2↑+4H+ | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-═PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4 | |
| D. | H3PO2溶于水的电离方程式为H3PO2?H++H2PO2- |
20.在下列条件下,两种气体的分子数一定相等的是( )
①同质量、不同密度的N2和C2H4 ②同温度、同体积的O2和N2
③不同温度压强下、同物质的量的CO2和C2H4 ④同压强、同体积的N2和O2.
①同质量、不同密度的N2和C2H4 ②同温度、同体积的O2和N2
③不同温度压强下、同物质的量的CO2和C2H4 ④同压强、同体积的N2和O2.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
17.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )
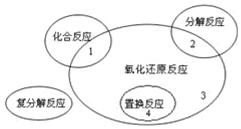

| A. | AgNO3+NaCl═AgCl↓+NaNO3 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ | D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
4.下列物质在水溶液中的电离方程式书写错误的是( )
| A. | NaHCO3=Na++H++CO32- | B. | NH4NO3=NH4++NO3- | ||
| C. | NaHSO4=Na++H++SO42- | D. | Ba(OH)2=Ba2++2OH- |
1.根据热化学方程式:S(s)+O2(g)=SO2(g)△H=a kJ•mol-1(a=-297.2),以下说法正确的是( )
| A. | 硫的燃烧热△H=+297.2 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g)△H=b kJ•mol-1,则a<b | |
| C. | 1 mol SO2(g)所具有的能量高于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | 16 g固体硫在空气中充分燃烧,可释放148.6 kJ的热量 |
18.在一定温度下,对可逆反应A(g)+3B(g)?4C(g)的下列叙述中,能说明反应已经达到达到平衡的是( )
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内amol A生成,同时生成3amol B | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的平均相对分子质量不变 |