题目内容
8.(1)同温同压下,同体积的NH3和H2O(水蒸气)质量比是17:18.(2)0.3mol NH3分子中所含质子数与3NA个H2O分子中所含质子数相等.
(3)含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是0.6mol.
(4)2molSO3和3molSO2其分子数之比为2:3;相同状况下(均为气体)体积之比为2:3.
(5)欲用98%的浓硫酸(ρ=1.84g/cm3 )配制成浓度为0.5mol/L的稀硫酸500mL.所需量取浓硫酸的体积为13.6mL.
分析 (1)依据阿伏伽德罗定律可知:同温同压下,同体积任何气体具有相同的物质的量,结合m=nM计算;
(2)依据N=nNA结合1个氨气分子和1个水分子都含有10个质子解答;
(3)硫酸铝为强电解质完全电离,1mol硫酸铝电离产生3mol硫酸根离子和2mol铝离子;
(4)依据n=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$解答;
(5)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸的体积.
解答 解:(1)依据阿伏伽德罗定律可知:同温同压下,同体积任何气体具有相同的物质的量,所以同温同压下,同体积的NH3和H2O(水蒸气)物质的量之比为1:1,质量之比:1×17:1×18=17:18;
故答案为:17:18;
(2)0.3mol NH3分子中所含质子数为0.3NA,1个氨气分子和1个水分子都含有10个质子,所以0.3NA 个H2O分子中所含质子数相等;
故答案为:0.3NA;
(3)硫酸铝为强电解质完全电离,1mol硫酸铝电离产生3mol硫酸根离子和2mol铝离子,设硫酸铝的物质的量为x,则x×2=0.4mol,x=0.2mol,含有硫酸根离子物质的量为0.2mol×3=0.6mol;
故答案为:0.6mol;
(4)依据n=$\frac{N}{{N}_{A}}$可知分子数与物质的量成正比,所以2molSO3和3molSO2其分子数之比为2:3;
依据n=$\frac{V}{Vm}$可知,相同状况下,n与V成正比,所以2molSO3和3molSO2其体积之比为2:3;
故答案为:2:3 2:3;
(5)98%的浓硫酸(ρ=1.84g/cm3 )物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸的体积为V,依据溶液稀释过程中所含溶质的物质的量不变得:18.4mol/L×V=0.5mol/L×500mL,解得V=13.6mL;
故答案为:13.6.
点评 本题考查了阿伏伽德罗常数的综合应用,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间关系是解题关键,题目难度不大.

 天天练口算系列答案
天天练口算系列答案乙酰苯胺的制备原理为

实验参数
| 名称 | 相对分 子质量 | 性状 | 密度(g/mL) | 沸点(℃) | 溶解性 | |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
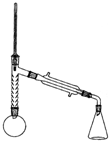
注:①刺型分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离.②苯胺易被氧化.
实验步骤:
步骤1:在100mL圆底烧瓶中加入无水苯胺9.3mL、冰醋酸18.4mL、锌粉0.1g和少量沸石,安装好仪器后,对圆底烧瓶均匀加热,使反应液在微沸状态下回流,调节加热温度,使温度计温度控制在105℃左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热.
步骤2:在搅拌下,趁热将蒸馏烧瓶中的液体以细流状倒入盛有冰水的100mL烧杯中,快速搅拌,乙酰苯胺结晶析出,烧杯内试剂冷却至室温后,进行抽滤、洗涤、干燥,可得到乙酰苯胺粗品.
步骤3:将乙酰苯胺粗品进行重结晶,待结晶完全后抽滤,尽量压甘干滤饼.将产品置于干净的表面皿中晾干,称重,计算产率、
请回答下列问题:
(1)实验中加入锌粉的目的是防止苯胺在反应过程中被氧化;.
(2)从化学平衡的角度分析,控制温度计的温度在105℃左右的原因是不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(3)通过温度计温度下降或锥形瓶内液体不再增加可判断反应基本完成、
(4)步骤1加热可用油浴(填“水浴”或“油浴”).
(5)洗涤乙酰苯胺粗品最合适的方法是A(填字母).
A.用少量冷水洗B.用少量热水洗
C.先用冷水洗,再用热水洗D.用酒精洗
(6)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,趁热过滤,再将滤液冷却结晶.
(7)该实验最终得到产品9.1g,则乙酰苯胺的产率是65.7%(小数点后保留两位数字.)
| A. | 用惰性电极电解NaH2PO2溶液,其阴极反应式为:2H2O-4e-═O2↑+4H+ | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-═PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4 | |
| D. | H3PO2溶于水的电离方程式为H3PO2?H++H2PO2- |
| A. | $\frac{ω}{5}$ g•mol-1 | B. | 2ωg | C. | 2ω g•mol-1 | D. | 4ω g•mol-1 |
①同质量、不同密度的N2和C2H4 ②同温度、同体积的O2和N2
③不同温度压强下、同物质的量的CO2和C2H4 ④同压强、同体积的N2和O2.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
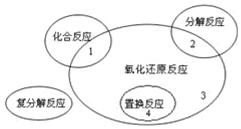
| A. | AgNO3+NaCl═AgCl↓+NaNO3 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ | D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内amol A生成,同时生成3amol B | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的平均相对分子质量不变 |
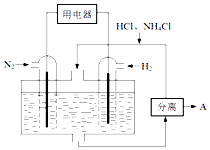 氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.