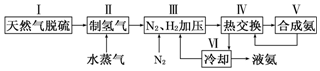
题目内容
13.KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为2KClO3+4HCl(浓)=2KCl+2ClO2↑+1Cl2↑+2H2O
(1)请配平上述化学方程式并用双线桥表示此反应转移的电子数目及方向.
(2)浓盐酸在反应中显示出来的性质是②(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)氧化剂是KClO3,氧化产物是Cl2.
分析 (1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;再结合元素守恒,可知未知物是水,配平各物质的系数;
(2)根据HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各有一半;
(3)KClO3中氯元素化合价由+5价降低为ClO2中+4价,则KClO3为氧化剂,HCl中氯元素化合价由-1价升高为Cl2中0价,则还原剂为HCl.
解答 解:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,结合元素守恒,可知未知物是水,水的系数是2,其反应方程式为:
2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O,电子转移如下: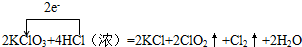
故答案为:2;4;2;2;1;2;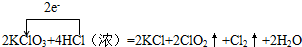 ;
;
(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各有一半,
故选:②;
(3)KClO3中氯元素化合价由+5价降低为ClO2中+4价,则KClO3为氧化剂,HCl中氯元素化合价由-1价升高为Cl2中0价,则还原剂为HCl,生成Cl2为氧化产物;故答案为:KClO3;Cl2.
点评 本题考查氧化还原反应基本概念、配平等,难度中等,判断氧化产物、还原产物是关键,注意同种元素反应氧化还原反应价态归中不交叉原则,难度不大.

 53天天练系列答案
53天天练系列答案| A. | NaHCO3=Na++H++CO32- | B. | NH4NO3=NH4++NO3- | ||
| C. | NaHSO4=Na++H++SO42- | D. | Ba(OH)2=Ba2++2OH- |
| A. | 硫的燃烧热△H=+297.2 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g)△H=b kJ•mol-1,则a<b | |
| C. | 1 mol SO2(g)所具有的能量高于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | 16 g固体硫在空气中充分燃烧,可释放148.6 kJ的热量 |
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内amol A生成,同时生成3amol B | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的平均相对分子质量不变 |
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在碱 式滴定管内,若用甲基橙
作指示剂,达到滴定终点时,溶液从红 色变为橙 色;
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第③种(填序号);
①2.500mol/L ②0.25mol/L ③0.025mol/L
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用C(Na2CO3)表示,滴定时实验数据列表如下:
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
数据和符号列式即可):C(HCl)=$\frac{17.00mL×0.025mol/L×2}{20.00mL}$.
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ•mol-1.
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8 kJ•mol-1 |
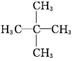 2,2-二甲基丙烷,写出它和氯气发生一取代反应的方程式
2,2-二甲基丙烷,写出它和氯气发生一取代反应的方程式 +HCl
+HCl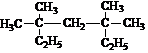 3,3,5,5-四甲基庚烷;它的一氯代物具有不同沸点的产物有4种
3,3,5,5-四甲基庚烷;它的一氯代物具有不同沸点的产物有4种 ;
; .
.