题目内容
20.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )| A. | 溶液中Ca2+数目不变 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值增大 | D. | 溶液pH值不变 |
分析 向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,消耗水,溶液c(Ca2+)、c(OH-)增大,由于原溶液已达到饱和,则平衡向逆反应方向移动,以此解答该题.
解答 解:向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,
A.加入CaO,消耗水,由于原溶液已达到饱和,则平衡向逆反应方向移动,溶液中Ca2+数目减少,故A错误;
B.反应后仍为饱和溶液,c(Ca2+)不变,故B错误;
C.反应后仍为饱和溶液,c(OH-)不变,溶液pH不变,故C错误;
D.反应后仍为饱和溶液,c(OH-)不变,溶液pH不变,故D正确.
故选D.
点评 本题考查难溶电解质的溶解平衡,题目难度中等,本题注意向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,从平衡移动的角度分析.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
8.CN-可以造成水体污染,某小组采用如下方法对污水进行处理如图1.

I.双氧水氧化法除NaCN
(1)NaCN的电子式为 ,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
(2)碱性条件下加入H202除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为2CN-+5H2O2+2OH-=CO32-+N2↑+6H2O
Ⅱ.CN -和Cr2072-联合废水处理法
(3)②中反应后无气体放出,该反应的离子方程式为
(4)步骤③中,每处理0.4mol Cr2072-,至少消耗Na2S2O30.3mol.
Ⅲ,电化学法处理CN -如2图装置模拟电化学法处理CN -,有关结果见表.
(5)若乙池中石墨(I)极产生无毒无害的物质,其电极反应式为2CN-+12OH--10e-=2CO32-+N2+6H2O
(6)该实验表明电化学法处理CN -时,影响处理速率的因素有负极的金属材料、氧气的浓度.

I.双氧水氧化法除NaCN
(1)NaCN的电子式为
 ,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-(2)碱性条件下加入H202除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为2CN-+5H2O2+2OH-=CO32-+N2↑+6H2O
Ⅱ.CN -和Cr2072-联合废水处理法
(3)②中反应后无气体放出,该反应的离子方程式为
(4)步骤③中,每处理0.4mol Cr2072-,至少消耗Na2S2O30.3mol.
Ⅲ,电化学法处理CN -如2图装置模拟电化学法处理CN -,有关结果见表.
| 实验 序号 | 电极 (X) | NaCI溶液浓度 (mol/L) | 甲中石墨表面通人气体 | 电流计读数 (A) |
| (1) | Fe | O.l | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5Ⅰ |
| (3) | Fe | 0.1 | 02 | 2Ⅰ |
| (4) | Al | 0.5 | 空气 | 1.6Ⅰ |
(6)该实验表明电化学法处理CN -时,影响处理速率的因素有负极的金属材料、氧气的浓度.
15.在密闭容器里,2A+B?2C,其反应速率分别用vA、vB、vC表示,则( )
| A. | 2vB=3vA | B. | 3vC=2vB | C. | vB=vA | D. | vC=2vB |
5.某主族元素R的最高正化合价与负化合价的代数和为4,由此可以判断( )
| A. | R元素的氢化物常温下可能为液态 | |
| B. | R一定是第ⅣA族元素 | |
| C. | R的气态氢化物化学式为H2R | |
| D. | R元素的气态氢化物比同周期其他元素的气态氢化物稳定 |
2.下列方法最难能制备氧气的是( )
| A. | 加热氯酸钾 | B. | 加热氯酸钾和二氧化锰 | ||
| C. | 加热高锰酸钾 | D. | 加热双氧水 |
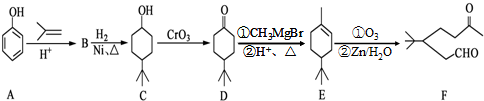
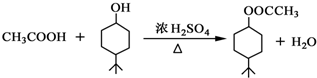 .
. .同时满足下列条件的B的同分异构体(不包括B)共有11种:
.同时满足下列条件的B的同分异构体(不包括B)共有11种: )和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线
)和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线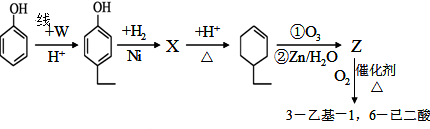
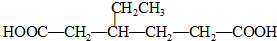
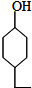 ,Z:
,Z: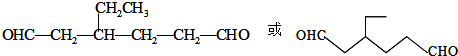 ;
;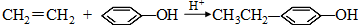 .
.
 ;Al
;Al ;O
;O ;C
;C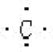 ;Cl-
;Cl- ;
; ;NaOH
;NaOH ;KBr
;KBr ;Na2S
;Na2S ;HI
;HI .
.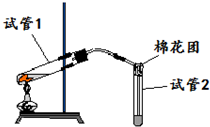 如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:
如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题: