题目内容
5.某主族元素R的最高正化合价与负化合价的代数和为4,由此可以判断( )| A. | R元素的氢化物常温下可能为液态 | |
| B. | R一定是第ⅣA族元素 | |
| C. | R的气态氢化物化学式为H2R | |
| D. | R元素的气态氢化物比同周期其他元素的气态氢化物稳定 |
分析 设R元素的最高正价为+x,则最低化合价为x-8,则有x+x-8=4,x=6,即R的原子最外层有6个电子,位于周期表第ⅥA族,O元素除外,结合元素周期律的递变规律解答该题.
解答 解:设R元素的最高正价为+x,则最低化合价为x-8,则有x+x-8=4,x=6,即R的原子最外层有6个电子,位于周期表第ⅥA族,O元素除外,则
A、因为O元素没有正化合价,所以R不可能是O元素,其它第VIA族元素氢化物都是气态,故A错误;
B、R的原子最外层有6个电子,位于周期表第ⅥA族,故B错误;
C、R的最低化合价为-2价,则对应的气态氢化物分子式为H2R,故C正确;
C.R位于周期表第ⅥA族,比同周期第ⅦA元素的非金属弱,对应的氢化物的稳定性也弱,故D错误;
故选C.
点评 本题考查元素的性质与推断,题目难度中等,本题注意氧族元素的性质的相似性和递变性.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 由反应SiO2+4HF═SiF4+2H2O,可知SiO2是碱性氧化物 | |
| B. | 由酸性溶液中MnO4-可以氧化Cl-,可知酸性溶液中MnO4-也能氧化Br- | |
| C. | 由反应CuSO4+H2S═CuS+H2SO4,可知酸性H2S>H2S04 | |
| D. | 由常温下金属钠、铝可溶于NaOH溶液,可知金属镁也能溶于NaOH溶液 |
13.废旧电池必须集中回收处理的首要原因是( )
| A. | 利用电池外壳的金属材料 | |
| B. | 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 | |
| C. | 不使电池中渗泄的电解液腐蚀其他物品 | |
| D. | 回收其中石墨电极 |
20.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
| A. | 溶液中Ca2+数目不变 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值增大 | D. | 溶液pH值不变 |
10.如图为周期表中短周期的一部分,若Z原子最外层电子数是其电子层数的2倍,则下列说法正确的是( )
| X | ||
| Y | Z |
| A. | Y的最高价氧化物对应水化物的酸性比Z的弱 | |
| B. | Y的气态氢化物的稳定性较Z的强 | |
| C. | 非金属性:X>Y>Z | |
| D. | 原子半径:Z>Y>X |
17.下列分子中的所有原子满足最外层8电子稳定结构的是( )
| A. | HCl | B. | BF3 | C. | NCl3 | D. | PCl5 |
6.汽车尾气作为空气污染的主要来源之一,其中含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等.对汽车尾气的治理使环境工作者面临了巨大的挑战.试回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
则由CH4将NO2完成还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(2)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4mol•L-1,
NO2-的水解常数为Kh=8.0×10-10mol•L-1,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kh的代数式表示),此时溶液的温度>25℃(“>”、“<”、“=”).
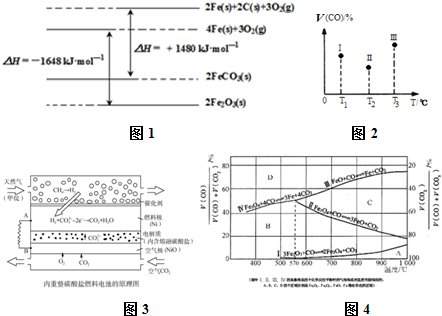
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=-90.8KJ•mol-1.不同温度下,CO的平衡转化率如图1所示:图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.
(4)化工上还可以利用CH3OH生成CH3OCH3.在体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g).
该反应的正反应为放热反应(填“吸热”、“放热”),若起始是向容器Ⅰ中充入CH3OH0.15mol、CH3OCH30.15mol和H2O0.10mol,则反应将向正方向进行(填“正”、“逆”).
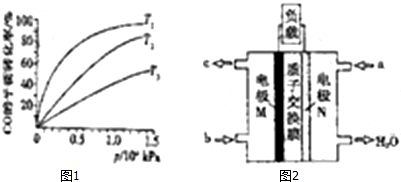
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为:2CH3OH+3O2=2CO2+4H2O,电池工作时的示意图如图2所示:质子穿过交换膜移向N电极区(填“M”、“N”),负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
(1)用CH4催化还原NOx可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
则由CH4将NO2完成还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(2)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4mol•L-1,
NO2-的水解常数为Kh=8.0×10-10mol•L-1,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kh的代数式表示),此时溶液的温度>25℃(“>”、“<”、“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=-90.8KJ•mol-1.不同温度下,CO的平衡转化率如图1所示:图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.

(4)化工上还可以利用CH3OH生成CH3OCH3.在体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g).
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为:2CH3OH+3O2=2CO2+4H2O,电池工作时的示意图如图2所示:质子穿过交换膜移向N电极区(填“M”、“N”),负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
7.将氢氧化钠溶液和氯化铝溶液等体积混合,得到的沉淀物中铝元素的质量与溶液中所含铝元 素的质量相等,则原氢氧化钠溶液和氯化铝溶液的物质的量浓度之比可能是( )
| A. | 3:1 | B. | 4:1 | C. | 3:2 | D. | 7:2 |