题目内容
8.CN-可以造成水体污染,某小组采用如下方法对污水进行处理如图1.
I.双氧水氧化法除NaCN
(1)NaCN的电子式为
 ,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-(2)碱性条件下加入H202除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为2CN-+5H2O2+2OH-=CO32-+N2↑+6H2O
Ⅱ.CN -和Cr2072-联合废水处理法
(3)②中反应后无气体放出,该反应的离子方程式为
(4)步骤③中,每处理0.4mol Cr2072-,至少消耗Na2S2O30.3mol.
Ⅲ,电化学法处理CN -如2图装置模拟电化学法处理CN -,有关结果见表.
| 实验 序号 | 电极 (X) | NaCI溶液浓度 (mol/L) | 甲中石墨表面通人气体 | 电流计读数 (A) |
| (1) | Fe | O.l | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5Ⅰ |
| (3) | Fe | 0.1 | 02 | 2Ⅰ |
| (4) | Al | 0.5 | 空气 | 1.6Ⅰ |
(6)该实验表明电化学法处理CN -时,影响处理速率的因素有负极的金属材料、氧气的浓度.
分析 Ⅰ、(1)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键;NaCN为强碱若酸盐,水解呈碱性;
(2)氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3;
Ⅱ、(3)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,据此写出离子方程式;
(4)根据发生反应的离子方程式进行计算;
(5)装置中阳极是发生氧化反应生成无毒无害的氮气和碳酸根离子;
(6)通过比较负极的金属材料和甲中电解质的浓度进行分析答题.
解答 解:Ⅰ、(1)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,电子式为 ,NaCN为强碱若酸盐,水解呈碱性,离子方程式为CN-+H2O?HCN+OH-,故答案为:
,NaCN为强碱若酸盐,水解呈碱性,离子方程式为CN-+H2O?HCN+OH-,故答案为: ;CN-+H2O?HCN+OH-;
;CN-+H2O?HCN+OH-;
(2)碱性气体为氨气,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,反应的化学方程式为:2CN-+5H2O2+2OH-=CO32-+N2↑+6H2O;
故答案为:2CN-+5H2O2+2OH-=CO32-+N2↑+6H2O;
Ⅱ、(3)步骤中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
(4)离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,每0.4molCr2O72-反应,消耗Na2S2O3的物质的量是0.3mol,故答案为:0.3mol;
(5)乙装置中阳极是发生氧化反应生成无毒无害的氮气和碳酸根离子,电极反应式为2CN-+12OH--10e-=2CO32-+N2+6H2O;故答案为:2CN-+12OH--10e-=2CO32-+N2+6H2O;
(6)通过比较表中的数据可知,影响处理速率的因素有负极的金属材料、电解质的浓度以及氧气的浓度,故答案为:负极的金属材料;甲中电解质氯化钠的浓度以及氧气的浓度.
点评 本题考查氧化还原反应的计算,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,明确流程图中化学反应原理、基本操作方法是解本题关键,难点氧化还原反应的计算,题目难度中等.

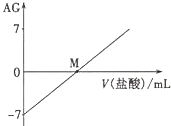 溶液的酸碱性可用酸度(AG)表示,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.室温下,将0.01mol•L-l盐酸逐滴滴人20.00mL 0.01 mol•L-l氨水中,溶液的AG变化如图所示.下列说法正确的是( )
溶液的酸碱性可用酸度(AG)表示,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.室温下,将0.01mol•L-l盐酸逐滴滴人20.00mL 0.01 mol•L-l氨水中,溶液的AG变化如图所示.下列说法正确的是( )| A. | 室温下,0.01 mol•L-l盐酸的AG=12 | B. | M点时溶液中:c(NH4+)=c(Cl-) | ||
| C. | M点加入盐酸的体积大于20.00 mL | D. | M点以后NH4+的水解程度逐渐增大 |
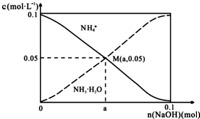 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 | |
| D. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| A. | 由反应SiO2+4HF═SiF4+2H2O,可知SiO2是碱性氧化物 | |
| B. | 由酸性溶液中MnO4-可以氧化Cl-,可知酸性溶液中MnO4-也能氧化Br- | |
| C. | 由反应CuSO4+H2S═CuS+H2SO4,可知酸性H2S>H2S04 | |
| D. | 由常温下金属钠、铝可溶于NaOH溶液,可知金属镁也能溶于NaOH溶液 |
 用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) | 气体 | a | b | C | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | CO2 | 稀硫酸 | 石灰石 | 饱和NaHCO3溶液 |
| C | 02 | 双氧水 | 二氧化锰 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 利用电池外壳的金属材料 | |
| B. | 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 | |
| C. | 不使电池中渗泄的电解液腐蚀其他物品 | |
| D. | 回收其中石墨电极 |
| A. | 溶液中Ca2+数目不变 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值增大 | D. | 溶液pH值不变 |
| A. | HCl | B. | BF3 | C. | NCl3 | D. | PCl5 |
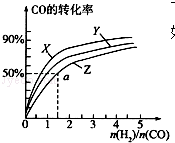 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1