题目内容
2.下列方法最难能制备氧气的是( )| A. | 加热氯酸钾 | B. | 加热氯酸钾和二氧化锰 | ||
| C. | 加热高锰酸钾 | D. | 加热双氧水 |
分析 实验室制备氧气可以利用氯酸钾加入二氧化锰催化剂加热分解生成氯化钾和氧气,也可以加热高锰酸钾固体分解生成锰酸钾、二氧化锰和氧气,加热过氧化氢分解生成水和氧气,或过氧化氢加入催化剂二氧化锰等不需加热分解生成氧气,据此制备方法分析选项反应的条件难易.
解答 解:A.氯酸钾加热到熔融才开始慢慢分解生成氧气,速率慢,需要加热的温度高;
B.加热氯酸钾和二氧化锰,二氧化锰催化作用,在温度较低条件下分解,反应速率快;
C.加热高锰酸钾固体,分解温度低,反应速率大;
D.过氧化氢受热易分解,反应速率快,
上述分析可知制备氧气最难的是加热氯酸钾固体分解制备氧气,
故选A.
点评 本题考查了实验室制备氧气的方法和反应条件分析判断,注意知识积累,题目较简单.

练习册系列答案
相关题目
20.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
| A. | 溶液中Ca2+数目不变 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值增大 | D. | 溶液pH值不变 |
13.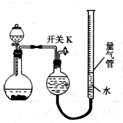 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”),原因是NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准.
(2)实验Ⅲ烧瓶中发生反应的化学方程式是CaC2+2H2O→Ca(OH)2+C2H2↑.
(3)实验Ⅱ中量气管中的液体最好是c(填字母).
a.浓NaOH溶液 b.氨水 c.煤油 d.饱和氯化铵溶液
(4)该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.

(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温;②使量气管与干燥管两端液面相平;③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
根据上述数据,可计算出镁铝合金中铝的质量分数为27.0%.
 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 过氧化钠、水 | O2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |
(2)实验Ⅲ烧瓶中发生反应的化学方程式是CaC2+2H2O→Ca(OH)2+C2H2↑.
(3)实验Ⅱ中量气管中的液体最好是c(填字母).
a.浓NaOH溶液 b.氨水 c.煤油 d.饱和氯化铵溶液
(4)该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.

(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温;②使量气管与干燥管两端液面相平;③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
| 编号 | 镁铝合金 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
17.一定量混合物在密闭容器中发生反应mA(g)+nB(g)?pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的$\frac{1}{2}$,当达到新平衡时,B物质的浓度变为原来的1.9倍.则下列说法正确的是( )
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数增大 | D. | A的转化率降低 |
7.将氢氧化钠溶液和氯化铝溶液等体积混合,得到的沉淀物中铝元素的质量与溶液中所含铝元 素的质量相等,则原氢氧化钠溶液和氯化铝溶液的物质的量浓度之比可能是( )
| A. | 3:1 | B. | 4:1 | C. | 3:2 | D. | 7:2 |
14.已知25℃,四种酸的电离平衡常数如表,下列叙述正确的是( )
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=4.2×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 等物质的量浓度的四种酸溶液中,pH最大的是亚硫酸 | |
| B. | 等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 | |
| C. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═$CO_3^{2-}$+2HClO | |
| D. | 醋酸与NaHSO3溶液反应的离子方程式为:CH3COOH+HSO3-═SO2+H2O+CH3COO- |
12.下列各组离子一定能大量共存的是( )
| A. | 澄清透明的无色溶液:MnO4- Na+ I- Mg2+ | |
| B. | 含有0.1mol/L Fe3+ 的溶液中:Na+ Ca2+ SCN- SO42- | |
| C. | 与铝片反应产生氢气的溶液:CO32- SO42- Na+ NH4+ | |
| D. | 使酚酞溶液变红的溶液:Na+ Cl- NO3- Ba2+ |
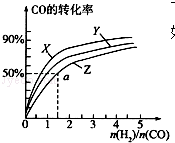 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1