题目内容
11.请回答:(1)Na2O2的电子式

(2)溶解在水中的O2在碱性条件下可以将Mn2+氧化成MnO(OH)2,写出该反应的离子方程式2Mn2++O2+4OH-=2MnO(OH)2
(3)工业上常通过高温分解FeSO4的方法制备Fe2O3,用化学方程式表示其原理2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
分析 (1)过氧化钠为离子化合物,阴阳离子需要标出所带电荷;
(2)分析锰元素,氧元素、碘元素在反应中化合价变化,依据氧化还原反应中得失电子守恒、原子个数守恒写出反应的离子方程式;
(3)高温分解FeSO4的方法制备Fe2O3,结合化合价变化判断反应产物,然后写出反应的化学方程式.
解答 解:(1)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,
,
故答案为: ;
;
(2)溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,锰元素化合价升高2价,氧气化合价降低了4价,根据化合价升高降低相等配平反应的离子方程式为:2Mn2++O2+4OH-=2MnO(OH)2,
故答案为:2Mn2++O2+4OH-=2MnO(OH)2;
(3)工业上常通过高温分解FeSO4的方法制备Fe2O3,亚铁离子化合价升高生成铁离子,则S元素的化合价降低被还原生成二氧化硫,反应的化学方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑,
故答案为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及化学方程式、离子方程式、电子式的书写,明确发生反应原理为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.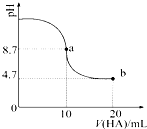 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
变化曲线如图所示.下列说法正确的是( )
 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| C. | 当加入HA溶液10mL时,c(OH-)<1.0×10-7mol•L-1 | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
2.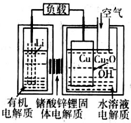 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 放电时,正极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| D. | 整个反应过程中,氧化剂为O2 |
19.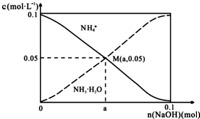 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 | |
| D. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
6.下列说法正确的是( )
| A. | 按系统命名法,化合物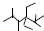 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 用酸性KMnO4 溶液可鉴别2-丁烯和正丁醛 | |
| C. | 用甘氨酸[H2N-CH2-COOH]和丙氨酸[CH3CH(NH2)COOH]缩合最多可形成3 种二肽 | |
| D. | 乙醇、乙二醇、丙三醇的沸点依次升高 |
16.下列说法正确的是( )
| A. | 由反应SiO2+4HF═SiF4+2H2O,可知SiO2是碱性氧化物 | |
| B. | 由酸性溶液中MnO4-可以氧化Cl-,可知酸性溶液中MnO4-也能氧化Br- | |
| C. | 由反应CuSO4+H2S═CuS+H2SO4,可知酸性H2S>H2S04 | |
| D. | 由常温下金属钠、铝可溶于NaOH溶液,可知金属镁也能溶于NaOH溶液 |
3. 用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
 用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) | 气体 | a | b | C | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | CO2 | 稀硫酸 | 石灰石 | 饱和NaHCO3溶液 |
| C | 02 | 双氧水 | 二氧化锰 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
20.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
| A. | 溶液中Ca2+数目不变 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值增大 | D. | 溶液pH值不变 |
13.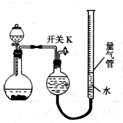 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”),原因是NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准.
(2)实验Ⅲ烧瓶中发生反应的化学方程式是CaC2+2H2O→Ca(OH)2+C2H2↑.
(3)实验Ⅱ中量气管中的液体最好是c(填字母).
a.浓NaOH溶液 b.氨水 c.煤油 d.饱和氯化铵溶液
(4)该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.

(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温;②使量气管与干燥管两端液面相平;③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
根据上述数据,可计算出镁铝合金中铝的质量分数为27.0%.
 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 过氧化钠、水 | O2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |
(2)实验Ⅲ烧瓶中发生反应的化学方程式是CaC2+2H2O→Ca(OH)2+C2H2↑.
(3)实验Ⅱ中量气管中的液体最好是c(填字母).
a.浓NaOH溶液 b.氨水 c.煤油 d.饱和氯化铵溶液
(4)该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.

(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温;②使量气管与干燥管两端液面相平;③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
| 编号 | 镁铝合金 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |