题目内容
1.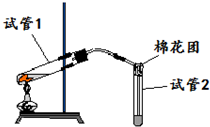 如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:
如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:(1)写出用铜片与浓硫酸制取SO2的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)若试管2中的溶液是KMnO4酸性溶液,反应一段时间后,观察到酸性KMnO4溶液褪色,说明了SO2具有还原性;
(3)实验过程中,试管2管口塞一团浸有NaOH溶液的棉花,其作用是吸收未反应的SO2气体(或SO2尾气处理,避免环境污染);
(4)反应结束后,为了观察产物硫酸铜的蓝色溶液,需将试管1中的溶液稀释,具体的操作是将试管沿烧杯内壁缓缓倒入烧杯中,并用玻璃棒不断搅拌.
分析 铜和浓硫酸在加热条件下能发生生成硫酸铜和二氧化硫、水,发生Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,生成的二氧化硫具有还原性,可与酸性高锰酸钾发生氧化还原反应,二氧化硫可与氢氧化钠溶液反应而被吸收,防止污染空气,以此解答该题.
解答 解:(1)浓硫酸与铜在加热条件下生成反应CuSO4、SO2和H2O,反应的化学方程式为Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)若试管2中的溶液是KMnO4溶液,反应一段时间后,二者发生氧化还原反应,高锰酸钾溶液褪色,证明二氧化硫具有还原性,故答案为:还原;
(3)二氧化硫有毒,所以不能直接排空,二氧化硫是酸性氧化物,能和碱反应生成盐和水,所以试管2的管口塞一团浸有NaOH溶液的棉花的作用是吸收未反应的SO2气体,离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:吸收未反应的SO2气体(或SO2尾气处理,避免环境污染);
(4)试管1中含有浓硫酸,稀释时为防止酸液飞溅,可将试管沿烧杯内壁缓缓倒入烧杯中,并用玻璃棒不断搅拌,故答案为:将试管沿烧杯内壁缓缓倒入烧杯中,并用玻璃棒不断搅拌.
点评 本题考查了浓硫酸的化学性质、二氧化硫的性质及检验方法,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意掌握浓硫酸的化学性质,明确二氧化硫的漂白性是暂时的,加热时会恢复原来的颜色.

练习册系列答案
相关题目
19.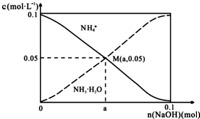 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 | |
| D. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
20.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
| A. | 溶液中Ca2+数目不变 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值增大 | D. | 溶液pH值不变 |
17.下列分子中的所有原子满足最外层8电子稳定结构的是( )
| A. | HCl | B. | BF3 | C. | NCl3 | D. | PCl5 |
4.对下列两种化合物的描述正确的是( )
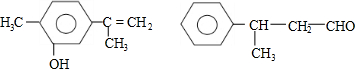
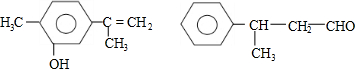
| A. | 可用红外光谱区分,但不能用核磁共振氢谱区分 | |
| B. | 分子中最多都有10个碳原子共平面 | |
| C. | 不是同分异构体 | |
| D. | 均能与溴水反应 |
6.汽车尾气作为空气污染的主要来源之一,其中含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等.对汽车尾气的治理使环境工作者面临了巨大的挑战.试回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
则由CH4将NO2完成还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(2)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4mol•L-1,
NO2-的水解常数为Kh=8.0×10-10mol•L-1,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kh的代数式表示),此时溶液的温度>25℃(“>”、“<”、“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=-90.8KJ•mol-1.不同温度下,CO的平衡转化率如图1所示:图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.
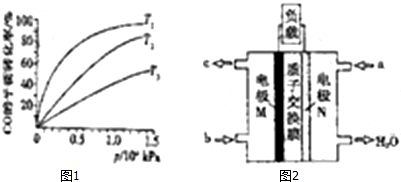
(4)化工上还可以利用CH3OH生成CH3OCH3.在体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g).
该反应的正反应为放热反应(填“吸热”、“放热”),若起始是向容器Ⅰ中充入CH3OH0.15mol、CH3OCH30.15mol和H2O0.10mol,则反应将向正方向进行(填“正”、“逆”).
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为:2CH3OH+3O2=2CO2+4H2O,电池工作时的示意图如图2所示:质子穿过交换膜移向N电极区(填“M”、“N”),负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
(1)用CH4催化还原NOx可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
则由CH4将NO2完成还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(2)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4mol•L-1,
NO2-的水解常数为Kh=8.0×10-10mol•L-1,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kh的代数式表示),此时溶液的温度>25℃(“>”、“<”、“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=-90.8KJ•mol-1.不同温度下,CO的平衡转化率如图1所示:图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.

(4)化工上还可以利用CH3OH生成CH3OCH3.在体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g).
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为:2CH3OH+3O2=2CO2+4H2O,电池工作时的示意图如图2所示:质子穿过交换膜移向N电极区(填“M”、“N”),负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
13.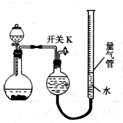 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”),原因是NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准.
(2)实验Ⅲ烧瓶中发生反应的化学方程式是CaC2+2H2O→Ca(OH)2+C2H2↑.
(3)实验Ⅱ中量气管中的液体最好是c(填字母).
a.浓NaOH溶液 b.氨水 c.煤油 d.饱和氯化铵溶液
(4)该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.

(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温;②使量气管与干燥管两端液面相平;③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
根据上述数据,可计算出镁铝合金中铝的质量分数为27.0%.
 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 过氧化钠、水 | O2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |
(2)实验Ⅲ烧瓶中发生反应的化学方程式是CaC2+2H2O→Ca(OH)2+C2H2↑.
(3)实验Ⅱ中量气管中的液体最好是c(填字母).
a.浓NaOH溶液 b.氨水 c.煤油 d.饱和氯化铵溶液
(4)该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.

(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温;②使量气管与干燥管两端液面相平;③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
| 编号 | 镁铝合金 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
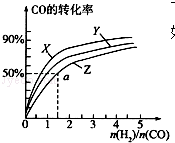 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1