题目内容
12.写出下列微粒的电子式:Mg
 ;Al
;Al ;O
;O ;C
;C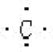 ;Cl-
;Cl- ;
;H2O
 ;NaOH
;NaOH ;KBr
;KBr ;Na2S
;Na2S ;HI
;HI .
.
分析 依据电子式书写的注意事项解答:
①无论何种微粒,其电子式都是由原子为基本单位组成的,不能出现角码甚至系数.
②组成各种微粒的各个原子的电子式,必须力求均匀、对称.稳定的8电子结构通常表示为四对电子(一般为元素符号的上、下、左、右各一对电子).
③电子式只能用于表示由主族元素形成的物质,不能表示由过渡元素形成的物质.电子式局限性较大,只能表述一小部分物质的结构.
解答 解:镁原子核外最外层有2个电子,电子式: ;
;
铝原子核外最外层有3个电子,电子式: ;
;
氧原子核外最外层有6个电子,电子式: ;
;
碳原子核外最外层有4个电子,电子式: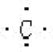 ;
;
氯离子核外最外层有8个电子,电子式: ;
;
水分子为共价化合物,分子中1个氧原子分别与2个氢原子共用1对电子,所以存在两个氧氢键,水的电子式为: ;
;
氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ;
;
溴化钾为离子化合物,钾离子与溴离子通过离子键结合,电子式为: ;
;
Na2S为离子化合物,钠离子用离子符号表示,硫离子标出最外层电子,硫化钠的电子式为: ;
;
碘化氢为共价化合物,氢原子与碘原子共用1对电子,电子式为: ;
;
故答案为: ;
; ;
; ;
;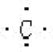 ;
; ;
; ;
; ;
; ;
; ;
; .
.
点评 本题考查了电子式的书写,题目难度不大,明确电子式的表示方法是解题关键.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
2.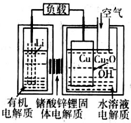 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 放电时,正极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| D. | 整个反应过程中,氧化剂为O2 |
3. 用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
 用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) | 气体 | a | b | C | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | CO2 | 稀硫酸 | 石灰石 | 饱和NaHCO3溶液 |
| C | 02 | 双氧水 | 二氧化锰 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
20.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
| A. | 溶液中Ca2+数目不变 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值增大 | D. | 溶液pH值不变 |
7.X、Y、Z、W是原子序数递增的四种短周期元素.X、Z同主族,且原子序数相差10;Y的最外层电子数是电子层数的三倍;W可与X、Z形成XW和ZW型化合物.下列说法错误的是( )
| A. | 化合物XW中含有共价键 | |
| B. | 化合物ZW中含有离子键 | |
| C. | X和Z可以形成离子化合物ZX | |
| D. | 化合物ZYX和ZYW所含有的键型不一样 |
17.下列分子中的所有原子满足最外层8电子稳定结构的是( )
| A. | HCl | B. | BF3 | C. | NCl3 | D. | PCl5 |
4.对下列两种化合物的描述正确的是( )
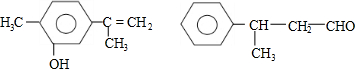
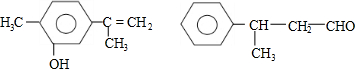
| A. | 可用红外光谱区分,但不能用核磁共振氢谱区分 | |
| B. | 分子中最多都有10个碳原子共平面 | |
| C. | 不是同分异构体 | |
| D. | 均能与溴水反应 |
13.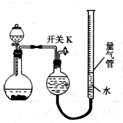 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”),原因是NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准.
(2)实验Ⅲ烧瓶中发生反应的化学方程式是CaC2+2H2O→Ca(OH)2+C2H2↑.
(3)实验Ⅱ中量气管中的液体最好是c(填字母).
a.浓NaOH溶液 b.氨水 c.煤油 d.饱和氯化铵溶液
(4)该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.

(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温;②使量气管与干燥管两端液面相平;③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
根据上述数据,可计算出镁铝合金中铝的质量分数为27.0%.
 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 过氧化钠、水 | O2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |
(2)实验Ⅲ烧瓶中发生反应的化学方程式是CaC2+2H2O→Ca(OH)2+C2H2↑.
(3)实验Ⅱ中量气管中的液体最好是c(填字母).
a.浓NaOH溶液 b.氨水 c.煤油 d.饱和氯化铵溶液
(4)该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.

(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温;②使量气管与干燥管两端液面相平;③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
| 编号 | 镁铝合金 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
14.已知25℃,四种酸的电离平衡常数如表,下列叙述正确的是( )
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=4.2×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 等物质的量浓度的四种酸溶液中,pH最大的是亚硫酸 | |
| B. | 等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 | |
| C. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═$CO_3^{2-}$+2HClO | |
| D. | 醋酸与NaHSO3溶液反应的离子方程式为:CH3COOH+HSO3-═SO2+H2O+CH3COO- |