题目内容
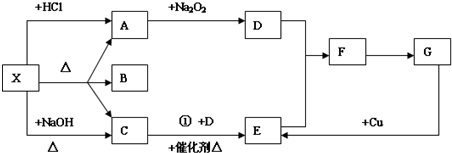
4.某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的元素符号可能是( )| A. | N | B. | Ne | C. | P | D. | C |
分析 可假设电子层数为x,则核电荷数=质子数=5x,质子数是最外层电子数的3倍,则最外层电子数为$\frac{5}{3}$x,以此来推断元素.
解答 解:设电子层数为x,则核电荷数=质子数=5x,质子数是最外层电子数的3倍,则最外层电子数为$\frac{5}{3}$x,显然x为3时,符合实际,即3个电子层,最外层电子数为$\frac{5}{3}$×3=5,所以元素为P,故选C.
点评 本题考查原子结构和元素性质,为高频考点,明确原子结构、原子核外电子排布是解本题关键,题目难度不大.

练习册系列答案
相关题目
14.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol•L-1 Na2CO3溶液中,含CO32-数目小于NA | |
| B. | 1molFeCl3完全转化为氢氧化铁胶体后,其中胶体粒子数目为NA | |
| C. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02 NA | |
| D. | 1 mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
12.2015年10月5日,诺贝尔奖官方推特消息,中国女药学家屠呦呦因创制新型抗疟药---青蒿素和双氢青蒿素 的贡献而获得诺贝尔生理学或医学奖.青蒿素结构简式如图,下列有关叙述正确的是( )
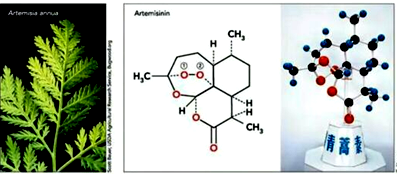

| A. | 青蒿素极易溶于水 | |
| B. | 1 mol青蒿素与足量NaOH溶液反应最多消耗4 mol NaOH | |
| C. | 青蒿素含有过氧键,有较强氧化性 | |
| D. | 青蒿素分子式为C15H21O5 |
19.金属冶炼的实质是( )
| A. | 金属元素失去电子 | |
| B. | 金属元素获得电子 | |
| C. | 金属元素被氧化了 | |
| D. | 金属元素可能被氧化了,也可能被还原了 |
16.最近科学家成功的制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是( )
| A. | 该物质的化学式为CO2 | |
| B. | 晶体的熔沸点高、硬度大 | |
| C. | 晶体中碳原子数与C-O化学键数之比为1:4 | |
| D. | 该物质的性质与二氧化碳相似 |
14.下列有关溶液中离子存在和转化的表达达合理的是( )
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12LCO2气体通入1L0.1mol/l的NaAlO2溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀 |
 按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液: