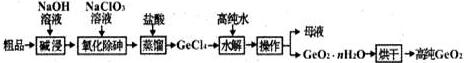
题目内容
14.下列有关溶液中离子存在和转化的表达达合理的是( )| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12LCO2气体通入1L0.1mol/l的NaAlO2溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀 |
分析 A.Fe3+存在于酸性条件下;
B.n(CO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,n(NaAlO2)=0.1mol/L×1L=0.1mol,当二氧化碳和偏铝酸钠的物质的量之比为1:2时,二者反应生成碳酸钠和氢氧化铝沉淀;
C.由水电离出的c(H+)=1×10-12mol/L的溶液中溶质可能是酸或碱,离子之间不反应且和氢离子或氢氧根离子之间不反应的能大量共存;
D.Ba2+、SO42-生成BaSO4沉淀,OH-先和Al3+反应生成Al(OH)3沉淀,后和NH4+反应生成一水合氨,最后和Al(OH)3反应生成AlO2-.
解答 解:A.Fe3+存在于酸性条件下,中性条件下,Fe元素以Fe(OH)3存在,故A错误;
B.n(CO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,n(NaAlO2)=0.1mol/L×1L=0.1mol,当二氧化碳和偏铝酸钠的物质的量之比为1:2时,二者反应生成碳酸钠和氢氧化铝沉淀,离子方程式为CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32-,故B错误;
C.由水电离出的c(H+)=1×10-12mol/L的溶液中溶质可能是酸或碱,离子之间不反应且和氢离子或氢氧根离子之间不反应的能大量共存,酸性条件下,碘离子和硝酸根离子发生氧化还原反应而不能共存,碱性条件下镁离子和氢氧根离子反应生成沉淀,故C错误;
D.Ba2+、SO42-生成BaSO4沉淀,OH-先和Al3+反应生成Al(OH)3沉淀,后和NH4+反应生成一水合氨,最后和Al(OH)3反应生成AlO2-,所以向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀,故D正确;
故选D.
点评 本题考查离子共存、离子方程式的书写等知识点,为高频考点,明确离子性质、离子共存条件是解本题关键,易错选项是A,注意D中离子反应先后顺序,题目难度不大.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案| A. | N | B. | Ne | C. | P | D. | C |
| A. | C2H2 | B. | C2H4 | C. | C3H8 | D. | C2H6 |
| A. | 无色的KI溶液在存放过程中会变成黄褐色 | |
| B. | 该溶液中Fe3+、K+、Cl-、H+不能大量共存 | |
| C. | 向碘溶液中加入KI可增大碘的溶解度 | |
| D. | 0.2molKI与Cl2完全反应,消耗的Cl2为2.24L |
| A. | 44g14C1802所含有的中子数为28NA | |
| B. | 32gCH4中所含共价键数为8NA | |
| C. | 7.8gNa2O2固体中所含离子数为0.4NA | |
| D. | 17gOH-所含有的电子数为9NA |
X(g)+Y(g)?Z(g);△H=-a kJ•mol-1(a>0).
经50s达平衡,此时Y的物质的量为1.2mol.下列说法错误的是( )
| A. | 用Z表示的化学反应速率为0.016 mol•L-1•s-1 | |
| B. | 恒温恒容下,通入Ne气,增大压强,Y的浓度不减小 | |
| C. | 恒温恒容下,再充入一定量的Z,重新达到平衡时,X的物质的量分数减小 | |
| D. | 达平衡后,实际放出的热量为b kJ,则b=a |
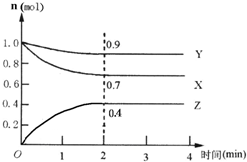 某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体).