题目内容
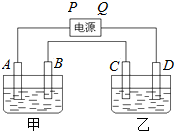 已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.
已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.(1)P,Q哪个是负极?
(2)当甲中溶液pH由6.0降到2.0时,B极质量增加多少克?若甲是1L CuSO4溶液,乙是100g 2%NaCl溶液,则乙溶液中的NaCl的质量分数变为多少?
考点:原电池和电解池的工作原理
专题:电化学专题
分析:通电后发现B极质量增加,说明在B极上析出金属,则应发生还原反应,可知A为阳极,B为阴极,C为阳极,D为阴极,P为正极,Q为负极,结合电极反应解答该题.
解答:
解:(1)通电后发现B极质量增加,说明在B极上析出金属,则应发生还原反应,可知A为阳极,B为阴极,C为阳极,D为阴极,P为正极,Q为负极,
答:Q为负极;
(2)若甲是1L CuSO4溶液,乙是100g NaCl溶液,
甲中阳极发生,阴极发生Cu2++2e-=Cu,阳极发生4OH--4e=2H2O+O2↑,乙中阳极发生2Cl--2e-=Cl2↑,阴极发生2H++2e-=H2↑,
当甲中溶液pH由6.0降到2.0时,则生成n(H+)=0.01mol,转移电子0.01mol,
则B极析出0.005molCu,质量为0.005mol×64g/mol=0.32g,
n(NaCl)=
=0.034mol,
转移0.01mol电子,则消耗0.01molNaCl,由阳极:2Cl--2e-=Cl2↑,阴极:2H++2e-=H2↑,可知生成0.005molCl2、0.005molH2,即消耗0.01molHCl,
所以电解后溶液的质量为100g-0.01mol×36.5g=99.635g,
剩余NaCl的质量为2g-0.01mol×58.5g/mol=1.415g,
所以电解后NaCl的质量分数为
×100%=1.42%,
答:B极质量增加0.32g,乙溶液中的NaCl的质量分数变为1.42%.
答:Q为负极;
(2)若甲是1L CuSO4溶液,乙是100g NaCl溶液,
甲中阳极发生,阴极发生Cu2++2e-=Cu,阳极发生4OH--4e=2H2O+O2↑,乙中阳极发生2Cl--2e-=Cl2↑,阴极发生2H++2e-=H2↑,
当甲中溶液pH由6.0降到2.0时,则生成n(H+)=0.01mol,转移电子0.01mol,
则B极析出0.005molCu,质量为0.005mol×64g/mol=0.32g,
n(NaCl)=
| 100g×2% |
| 58.5g/mol |
转移0.01mol电子,则消耗0.01molNaCl,由阳极:2Cl--2e-=Cl2↑,阴极:2H++2e-=H2↑,可知生成0.005molCl2、0.005molH2,即消耗0.01molHCl,
所以电解后溶液的质量为100g-0.01mol×36.5g=99.635g,
剩余NaCl的质量为2g-0.01mol×58.5g/mol=1.415g,
所以电解后NaCl的质量分数为
| 1.415 |
| 99.635 |
答:B极质量增加0.32g,乙溶液中的NaCl的质量分数变为1.42%.
点评:本题综合考查原电池和电解池知识,侧重于学生的分析能力和计算能力的考查,为高频考点,难度中等,注意把握电极方程式的书写.

练习册系列答案
相关题目
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A、在密闭容器中加入1.5molH2和0.5molN2,充分反应后可得NH3分子数目为NA |
| B、足量的铁粉与lmolCl2在加热条件下充分反应,转移的电子数为3NA |
| C、标准状况下,等物质的量的N2和CO所含分子数均为NA |
| D、7.8 g Na2O2中含有的离子总数目为0.3NA |
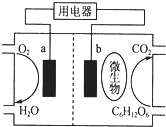 以葡萄糖为燃料的微生物燃料电池结构如图所示.a为电池的正极,关于该电池的叙述正确的是( )
以葡萄糖为燃料的微生物燃料电池结构如图所示.a为电池的正极,关于该电池的叙述正确的是( )| A、该电池能够在高温下工作 |
| B、b电极发生还原反应 |
| C、O2在a电极被氧化 |
| D、电流从a电极经用电器流向b电极 |

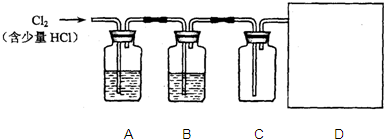
 试管B中的试剂为澄清石灰水.向试管A中滴入盐酸.
试管B中的试剂为澄清石灰水.向试管A中滴入盐酸.
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示: